
10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. 2. Diketahui Mr Urea (CO(NH2)2) = 60 g/mol, Kf air = 1,86 0 C/m, dan tekanan uap pelarut air pada suhu 25 0 C sebesar 23,75 mmHg, dan tekanan uap larutan urea pada 25 0 C sebesar 22,56 mmHg. Titik beku larutan urea tersebut adalah…
Modul I Sifat Koligatif Larutan Penurunan Titik Beku Larutan Mobile
Penurunan titik beku Titik beku adalah suhu pada tekanan tertentu yang menyebabkan perubahan zat dari cair ke wujud padat. Jika zat pelarut (air) dicampur dengan zat terlarut dan didinginkan hingga 0⁰C, ternyata larutan tersebut tidak membeku.. Agar bisa beku, maka larutan harus didinginkan dengan suhu yang lebih rendah lagi. Hal ini.
Berikut ini data titik beku beberapa larutan dalam...
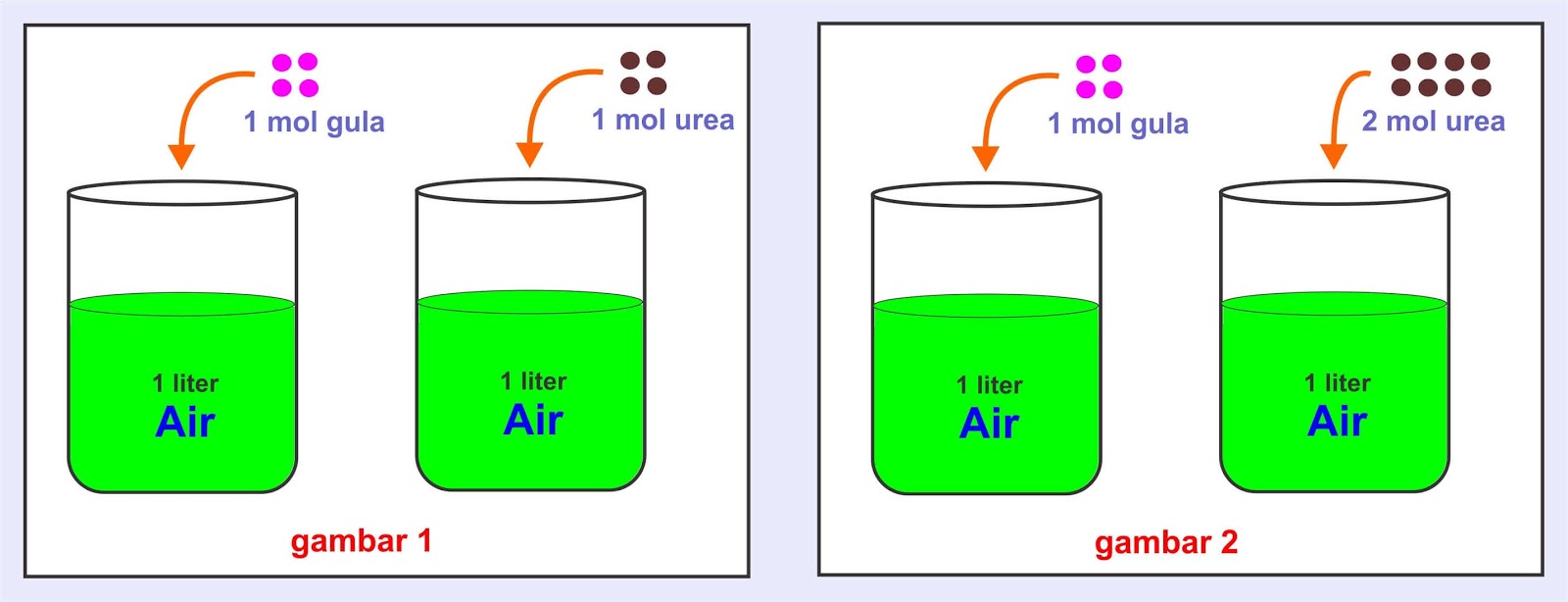
Sifat koligatif larutan itu ada empat macam, yaitu p enurunan tekanan uap (Δ P), penurunan titik beku (Δ Tf), kenaikan titik didih. Contoh dari larutan nonelektrolit adalah larutan gula seperti glukosa, sukrosa dan maltosa, larutan urea (CON 2 H 4), serta larutan alkohol seperti metanol,.

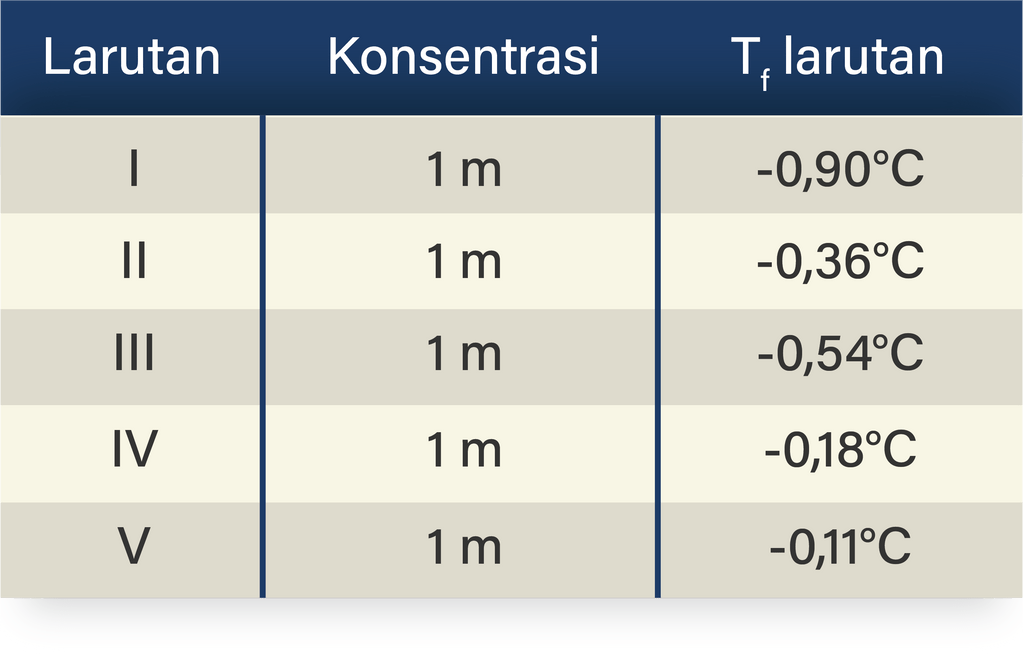
Data percobaan penurunan titik beku Larutan Konsentrasi
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.
Larutan berikut yang memiliki titik beku paling tinggi ad...
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. [3] Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
Persamaan Penurunan Titik beku. Penurunan titik beku dapat dihitung menggunakan persamaan Clausius-Clapeyron dan hukum Raoult. Dalam larutan ideal encer titik beku adalah: Titik beku larutan total = Titik beku larutan - ΔTf. dimana ΔTf = molalitas * Kf * i. K f = konstanta titik beku air (1,86 ° C kg / mol ) i = Faktor Van't Hoff.

Penurunan Titik Beku Larutan Adalah Reverasite
Titik beku. Titik beku adalah suatu kondisi suhu saat zat cair berubah wujud menjadi padat. Adapun titik beku besarnya sama dengan titik lebur yakni 0°C. Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan

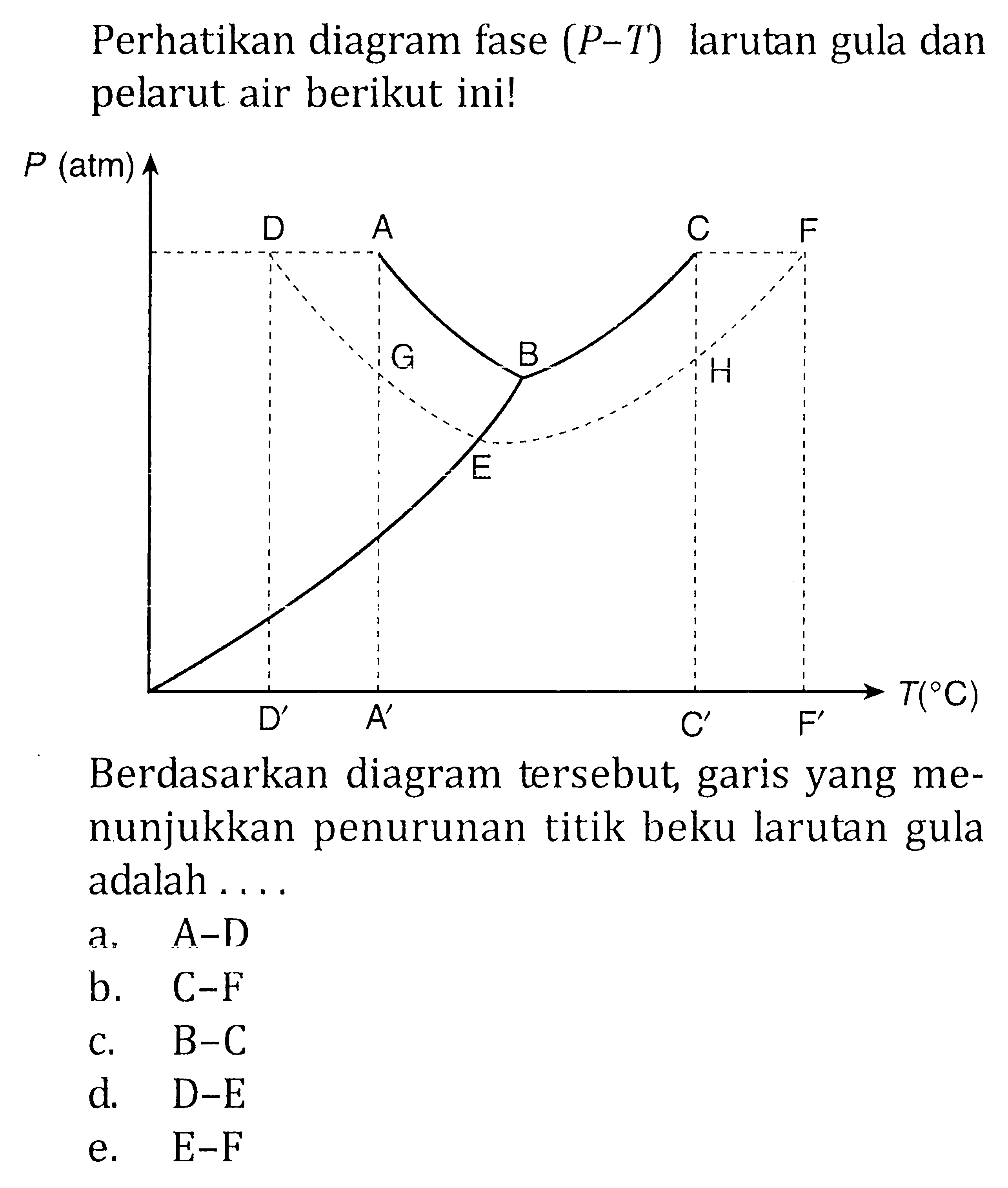
Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Penurunan titik beku adalah salah satu sifat koligatif larutan yang dipengaruhi oleh beberapa faktor. Faktor-faktor yang mempengaruhi penurunan titik beku meliputi: Konsentrasi Partikel Terlarut: Semakin tinggi konsentrasi partikel terlarut dalam larutan, semakin besar penurunan titik beku yang terjadi. Ini berarti larutan dengan konsentrasi.

Praktikum Penurunan Titik Beku Pada Pembuatan Es Krim II Sifat Koligatif Larutan YouTube
LAPORAN PRAKTIKUM KIMIA PENURUNAN TITIK BEKU LARUTAN. Titik beku adalah suhu dimana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah daripada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama daripada pelarut.

Larutan yang memiliki titik beku paling rendah adalah.
Titik beku larutan lebih rendah pelarut murni. Titik beku adalah suhu saat suatu zat menjadi beku di bawah tekanan 1 atm. Misalnya air, air adalah pelarut murni yang memiliki titik beku 0°C. Artinya, air yang awalnya cair akan berubah menjadi padat pada suhu 0°C. Dilansir dari Thought Co, larutan memiliki titik beku yang lebih rendah daripada.
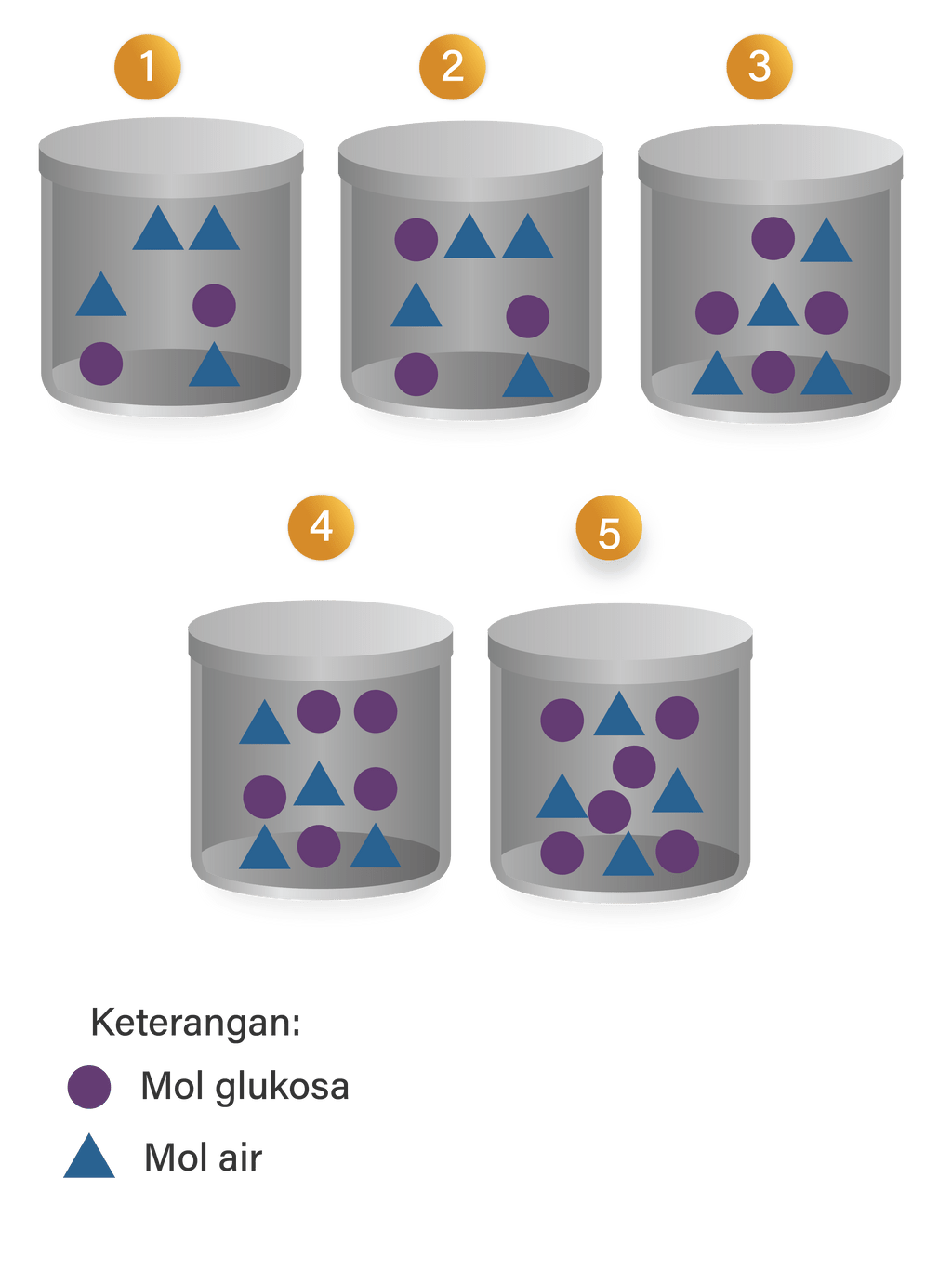
Perhatikan bagan berikut Larutan yang mem...
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Kemudian, adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah. Baca Juga: Pengertian Senyawa Polimer. Nah, berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut.

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Tf larutan (Tb) = Titik beku larutan (°C) Tf pelarut (Tb°) = Titik beku pelarut (°C) ΔTf = Penurunan titik beku (°C) m = Molalitas larutan (molal). Jadi, larutan yang isotonik dengan C6H12O6 0,3 M adalah larutan CaCl2 0,1 M. 4. Tekanan uap jenuh air pada suhu 28⁰C adalah 100 mmHg. Apabila 30 gram urea (Mr=60) dilarutkan dalam 2 mol.

Ppt Pembentukan Larutan Dan Konsentrasi Larutan Powerpoint Riset
Berikut adalah contoh soal materi sifat koligatif larutan kelas 12 semester 1 serta jawabannya. 1. Semua sifat berikut tergolong sifat koligatif larutan, kecuali.. A. Penurunan Tekanan Uap. B. Kenaikan Titik Didih. C. Penurunan Titik Beku. D. Tekanan Osmosis. E. Kepekatan Larutan.
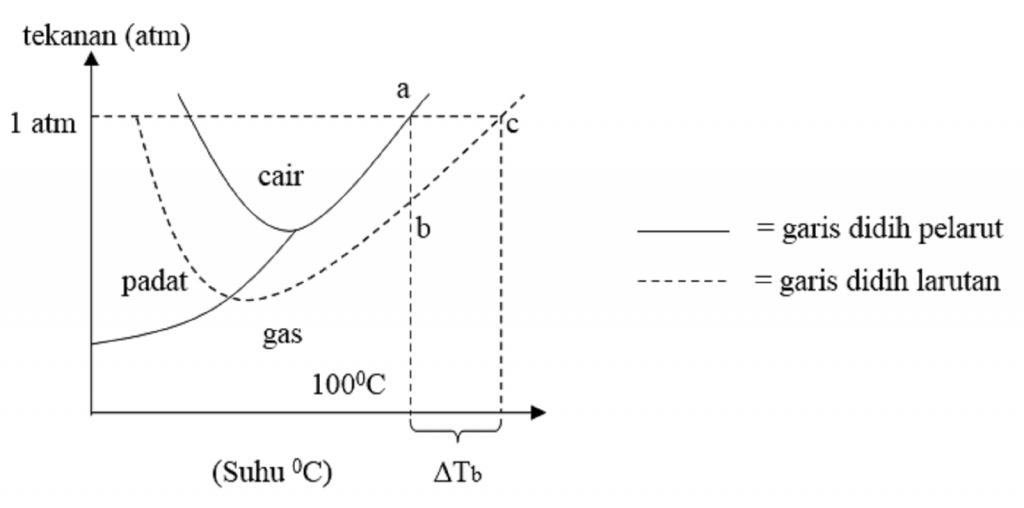
Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Misalnya, titik beku normal air adalah 0 o C. Akan tetapi, dengan adanya zat terlarut pada suhu 0 o C, air bisa mejadi belum membeku. Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf

Larutan 0,1 molal berikut yang memiliki titik beku terend...
Titik beku heksana, yang merupakan senyawa hidrokarbon alifatik, adalah sekitar -95 derajat Celsius atau -139 derajat Fahrenheit. 18.Hidroklorida (HCI) Titik beku larutan asam hidroklorida tergantung pada konsentrasi. Sebagai contoh, larutan 20% HCl memiliki titik beku sekitar -27 derajat Celsius atau -16.6 derajat Fahrenheit. 19.Helium