
Suatu larutan dibuat dengan mencampurkan 100 ml larutan...
Jadi, volume larutan setelah pengenceran adalah 1.000 mL, berarti volume pelarut yang ditambahkan: ∆V = V 2 - V 1 = 1.000 - 100 = 900 mL. Contoh 4. Larutan HCl 0,1 M sebanyak 100 mL dicampurkan dengan 150 mL larutan HCl 0,2 M. Tentukanlah konsentrasi larutan setelah dicampurkan! Pembahasan: Ingat, rumus molaritas pencampuran adalah:
PEMBUATAN LARUTAN 1000 ML Na2S2O3 0,1 N DARI PADATAN Na2S2O3 5H2O
Suatu larutan terdiri atas dari dua komponen yang penting. Biasanya salah satu komponen yang mengandung jumlah zat yang lebih banyak disebut pelarut (solvent). Pelarut dipandang sebagai pembawa atau medium zat terlarut yang dapat berperan serta dalam reaksi kimia. Kemudian, komponen lainnya yang mengandung zat yang lebih sedikit disebut zat.

Cara Menghitung Ph Larutan Asam Kuat Dan Asam Lemah Panduan Kimia Riset Sexiz Pix
Tanpa Sobat pintar sadar, Sobat Pintar sudah membuat suatu larutan nih dalam ilmu kimia. Foto oleh Artem Podrez dari Pexels. Apa yang dimaksud Larutan ? Pengertian larutan adalah campuran homogen dari dua atau lebih zat. Nah, larutan terdiri dari zat terlarut dan zat pelarut yang sifatnya homogen. - Zat pelarut: zat yang melarutkan zat lainnya.
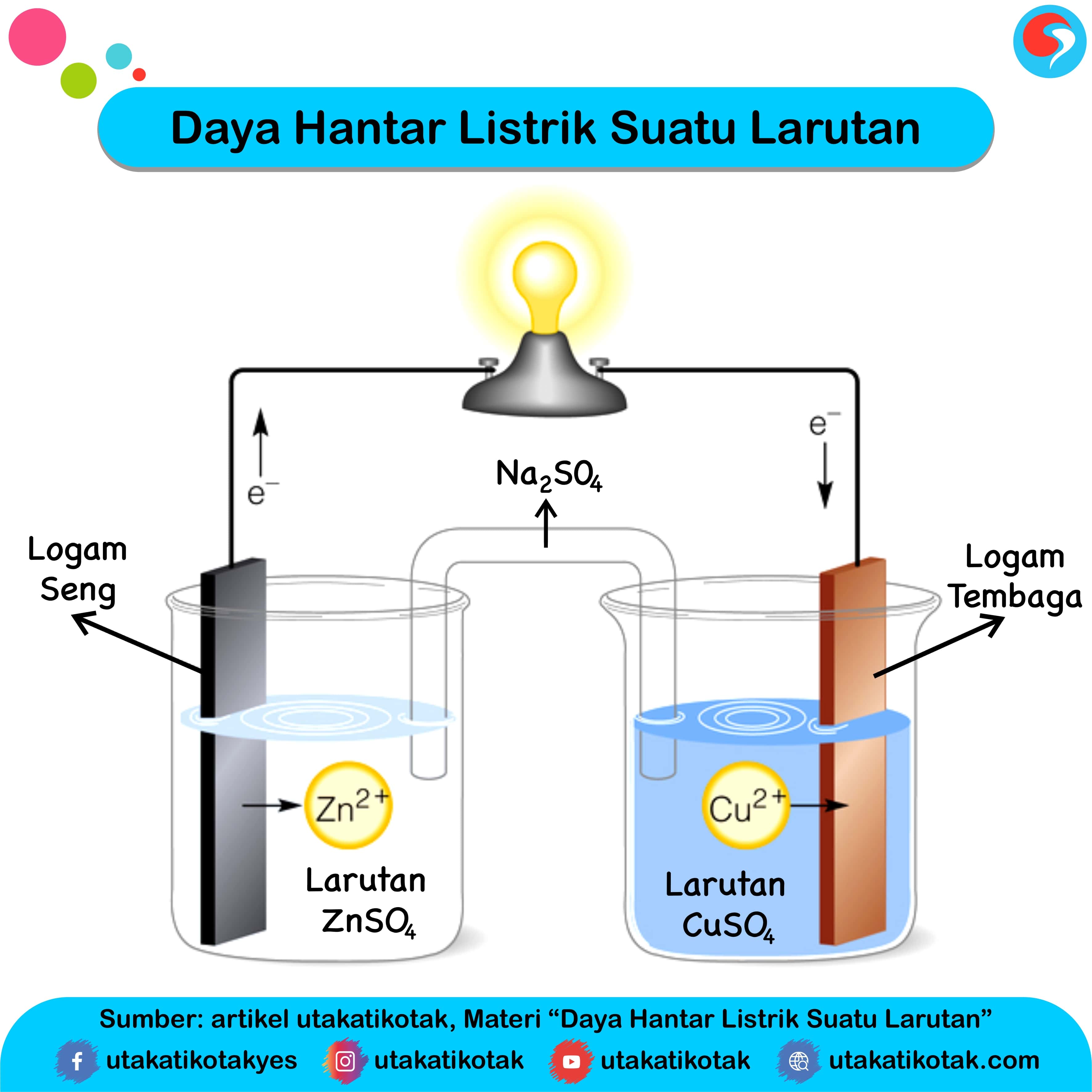
Daya Hantar Listrik Suatu Larutan
Sifat koligatif larutan adalah suatu sifat larutan yang hanya dipengaruhi oleh jumlah partikel zat terlarut. Jadi, semakin banyak zat terlarut, maka sifat koligatifnya akan semakin besar. Hmm, maksudnya gimana, sih? Baca Juga: Yuk, Kenali Perbedaan Unsur, Senyawa, dan Campuran.

SifatSifat Larutan Asam, Basa dan Garam
Jika suatu larutan bersifat asam, maka ia akan memerahkan lakmus biru. Sementara itu, jika larutannya bersifat basa maka ia akan membirukan lakmus merah. Jangan terbalik, ya! Terakhir, larutan atau senyawa asam bersifat korosif, sedangkan basa bersifat kaustik. Baca juga: Pengertian Isomer, Jenis-jenisnya, Serta Contohnya . Cara Membedakan Asam.

Konsentrasi Larutan dan Pengenceran Larutan adalah suatu zat
Sederhanya, suatu larutan terbentuk dari 10 bagian fruktosa yang terlarut dalam 90 bagian air. Misalnya, massa larutan adalah 100 gram, maka berat fruktosa adalah 10 gram dan berat air adalah 90 gram. Setelah mengetahui massa pelarutnya, kita dapat menghitung molalitasnya. Sehingga, molalitas larutan fruktosa 10% adalah 0,62 molal.

Suatu larutan gula (Mr = 342 g mol^1) membeku pada suhu
Hubungan Kelarutan (s) dan Tetapan Hasil Kali Kelarutan (K sp) Kelarutan dari suatu zat dapat berubah bergantung pada beberapa faktor. Misalnya, kelarutan dari senyawa hidroksida seperti Mg (OH) 2, bergantung pada pH larutan. Kelarutan zat juga dipengaruhi oleh konsentrasi ion-ion lain dalam larutan, khususnya ion-ion senama.

fraksi mol natrium hidroksida(Mr 40)suatu larutan
Konsentrasi Larutan. Dalam ilmu kimia, konsentrasi adalah ukuran yang menggambarkan banyaknya zat di dalam suatu campuran dibagi dengan volume total campuran tersebut. Terdapat empat macam deskripsi kuantitatif konsentrasi, yaitu konsentrasi massa, konsentrasi molar, konsentrasi jumlah, dan konsentrasi volume.

Cara Menghitung Konsentrasi Larutan Dalam Persen
Larutan ideal. Diagram tekanan uap (p, x) pada campuran benzena/toluena pada suhu 20°C. Bila interaksi antarmolekul komponen-komponen larutan sama besar dengan interaksi antarmolekul komponen-komponen tersebut pada keadaan murni, terbentuklah suatu idealisasi yang disebut larutan ideal. Larutan ideal mematuhi hukum Raoult, yaitu bahwa tekanan.

Soal Larutan Asam dan Basa 2021 Bagian1 Urip dot Info
Larutan mempunyai sifat yang tergantung pada jumlah partikel zat terlarutnya dalam suatu larangan. Tidak hanya itu saja, larutan juga tidak bergantung pada jenis partikel zat perlarut apapun. Sifat aditf. Pada sifat aditif, larutan akan bergantung pada atom total dalam molekul atau pada jumlah sifat konstituen larutan. Sifat konstitutif

Suatu larutan dibuat dengan melarutkan 3 gram asam asetat...
D. Suatu larutan sebanyak 1 L harus mengandung 360 g NaCl agar NaCl dapat larut. E. Suatu larutan sebanyak 1 L hanya dapat melarutkan paling banyak 360 g NaCI. Jawaban: E. Suatu larutan sebanyak 1 L hanya dapat melarutkan paling banyak 360 g NaCI. Pembahasan: Kelarutan merupakan jumlah maksimum suatu zat yang dapat larut dalam suatu larutan.
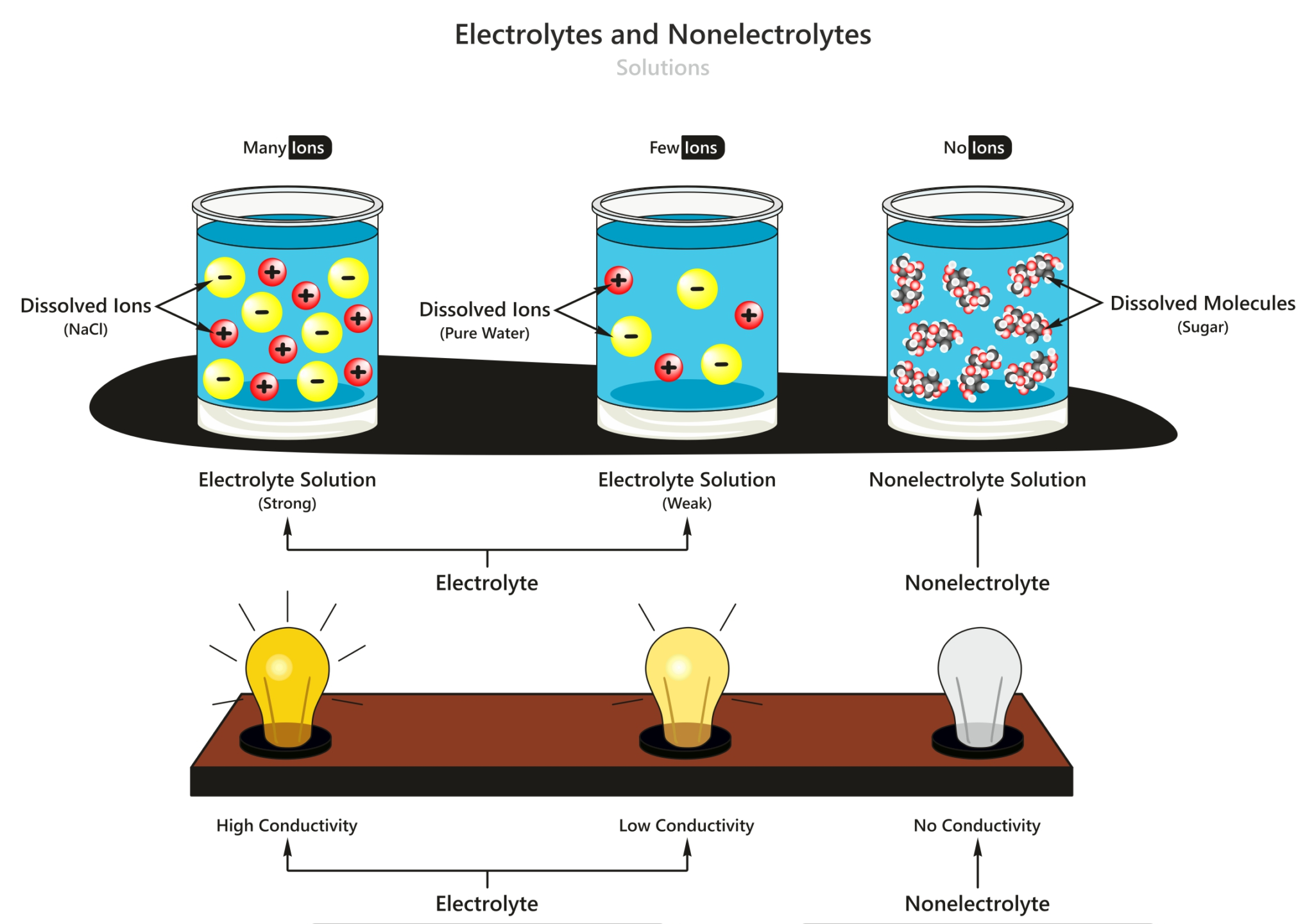
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Suatu larutan termasuk ke dalam larutan jenuh ketika terjadi kesetimbangan antara zat terlarut dan zat pelarut. Pada larutan jenuh partikel-partikelnya tepat bereaksi dengan pereaksi atau mengalami konsentrasi maksimal. Baca juga: Bulu Tangkis: Sejarah, Aturan Permainan, dan Teknik Dasarnya.

Suatu Larutan Yang Dibuat Dengan Melarutkan 1 Mol Na2so4
Mengutip e-modul Kimia: Peranan Elektrolit dalam Tubuh (2017) yang diterbitkan Kemdikbud, definisi larutan adalah campuran homogen yang tersusun dari pelarut dan zat terlarut. Secara umum larutan kerap dikenal dalam bentuk zat cair. Namun, sebenarnya larutan juga bisa berbentuk gas dan padat. Contoh larutan berupa gas adalah gas nitrogen.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Salah satu contoh larutan dalam kimia adalah H2SO4 (asam sulfat). Jika larutan H2SO4 (asam sulfat) dialiri listrik, maka akan menghantarkan listrik. Pada umumnya, suatu larutan terdiri satu jenis zat terlarut dan satu pelarut. Solvent (pelarut) dan Solut (zat yang terlarut) biasanya sudah sering didengar dan disebutkan.

PPT PEMBENTUKAN LARUTAN dan KONSENTRASI LARUTAN PowerPoint Presentation ID5586096
Pengertian Konsentrasi Larutan. Konsentrasi larutan adalah besaran yang menunjukkan kepekatan suatu larutan melalui perbandingan antara pelarut dan zat terlarut. Jika zat terlarutnya banyak, maka larutan yang dibentuk memiliki konsentrasi tinggi (pekat). Sebaliknya, jika zat terlarutnya sedikit, larutan yang dibentuk memiliki konsentrasi rendah.

Larutan Penyangga
Faktor-faktor ini secara tepat dijelaskan oleh hukum Lambert dan Beer. Hukum Beer-Lambert menyatakan bahwa energi yang diserap atau ditransmisikan oleh suatu larutan berbanding lurus dengan absorptivitas molar larutan dan konsentrasi zat terlarut. Hukum ini banyak digunakan dalam kimia analitik untuk mengukur absorbansi berbagai sampel.