
Jika diketahui Ksp Ag2CrO4=4 x 10^12 , konsentrasi ion
The [Ag+] in a saturated solution of Ag2CrO4 is 4 x 10−4 mol/L. Find Ksp of Ag2CrO4. The K s p of A g 2 C r O 4 is 1.1 × 10 − 12 at 298 K. The solubility (in mol L − 1) of A g 2 C r O 4 in a 0.1 M A g N O 3 solubility is: The ksp of Ag2CrO4 is 1.1 ×10−12 at 298k.
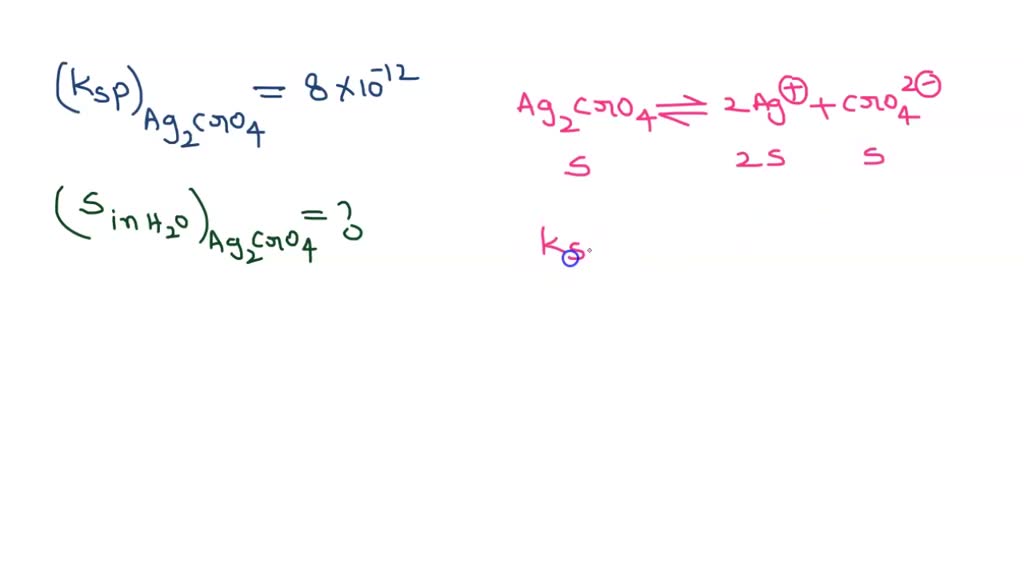
SOLVED Jika ksp Ag2CrO4 adalah 4x 10pangkat12 , kelarutan Ag2CrO4 (Mr= 332) dalam air adalah
Silver chromate is a chemical compound of silver and hexavalent chromium. It is used in photography. Hexavalent chromium refers to chemical compounds that contain the element chromium in the +6 oxidation state. Chromium (VI) is more toxic than other oxidation states of the chromium atom because of its greater ability to enter cells and higher.
Jika Ksp Ag2CrO4 = 4 x10^12, kelarutan Ag2CrO4 da...
Question: Which is the correct Ksp expression for Ag2CrO4 (s) dissolving in water? Ksp = [Ag*12(CrO42-1 Ksp = (Ag*12[Cr3+][02-14 Ksp = [A8+][Cro_2-12 Ksp - [Ag*][Cro42-1 . Show transcribed image text. There are 2 steps to solve this one. Who are the experts?

The Ksp for a sparingly soluble Ag2Cro4, is4 * 1012. The molar solubility of the salt is(1) 2.0
Ksp = 1.12x10-12. Ksp = [Ag +] 2 [CrO 4 2-] The common ion would be CrO 4 2-since you have 1.20 M potassium chromate (K 2 CrO 4). Because the [CrO 4 2-] is so large from the potassium chromate (1.2 M) we can ignore the [CrO 4 2-] contributed by the Ag 2 CrO 4 as it will be very small. Now we can write the Ksp expression as follows: Ksp = [Ag.

SOLVED The Ksp of silver chromate (Ag2CrO4) is 1.12 X1012 (a) What is the solubility of the
Rumus Hasil Kali Kelarutan Ksp Ag2Cro4. Untuk menghitung Ksp Ag2Cro4, kita perlu mengetahui persamaan reaksi pembentukannya terlebih dahulu. Reaksi pembentukan Ag2Cro4 dapat dituliskan sebagai berikut: 2AgNO3 + K2CrO4 → Ag2CrO4 + 2KNO3. Dari persamaan reaksi di atas, kita dapat mengetahui bahwa satu mol Ag2CrO4 terbentuk dari satu mol AgNO3.

The Ksp of Ag2CrO4 is 1.1 × 10^12 at 298 K . The solubility (in mol L^1 ) of Ag2CrO4 in a 0.1
Contoh Soal Kelarutan dan Hasil Kali Kelarutan (KSP) dan Pembahasan Contoh Soal 1: Hitunglah kelarutan Cu(OH) 2 dalam satuan g/L, jika diketahui K sp Cu(OH) 2 = 2,2 × 10 −20. Pembahasan: Contoh Soal 2: Hitunglah kelarutan molar PbI 2 dalam larutan KI 0,1 M. (K sp PbI 2 = 7,1 × 10 −9) Pembahasan: Dalam larutan, KI akan terdisosiasi menjadi.
the ksp of AgCrO4 is 1.1 ×10^ 12 at 298K. the solubility of Ag2CrO4 in a 0.1 M AgNO3 solution is?
Hasil Kali Kelarutan (Ksp) adalah hasil kali konsentrasi ion-ion yang masing-masing dipangkatkan dengan koefisiennya. Ag₂CrO₄ ⇌ 2Ag⁺ + CrO₄²⁻ Rumus Kspnya adalah Ksp = [Ag⁺]² [CrO₄²⁻] Terima kasih telah bertanya di Roboguru, semoga kamu dapat memahami penjelasan diatas. Selamat belajar!

The Ksp of Ag2CrO4, AgCl, AgBr AgI are respectively, 1.1× 10 12, 1.8 × 10 10, 5.0 × 10 13, 8.3 ×
Silver chromate is an inorganic compound with formula Ag 2 CrO 4 which appears as distinctively coloured brown-red crystals. The compound is insoluble and its precipitation is indicative of the reaction between soluble chromate and silver precursor salts (commonly potassium/sodium chromate with silver nitrate). This reaction is important for two uses in the laboratory: in analytical chemistry.

The Ksp of Ag2CrO4 , AgCl, AgBr and AgI are respectively, 1.1 × 10^12, 1.8 × 10^10, 5.0 × 10
Halo friend ada pertanyaan mengenai kelarutan dan hasil kali kelarutan Nah kita disuruh untuk mencari rumus hasil kali kelarutan atau KSP ag2 cro4 AG 2 cro4 ini akan terurai menjadi 2 AG plus ditambah cro4 2min untuk kelarutan ag2 cro4 yaitu untuk AG + yaitu 2s dan untuk cro4 2min adalah es untuk menentukan KSP nya yaitu larutan dari AG + berpangkat 2 sesuai dengan koefisien kali kelarutan.
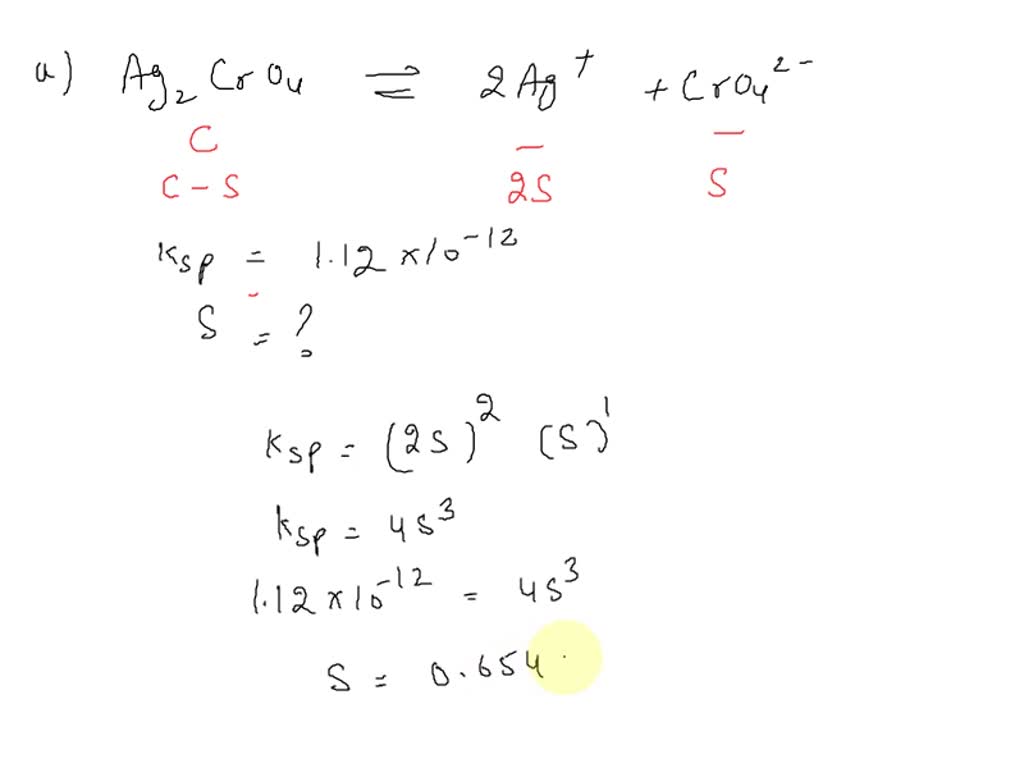
SOLVED Calculate the molar solubility of Ag2CrO4 (Ksp = 1.12×10^12) in (a) Pure water (b) In
Kelarutan dan Hasil Kali Kelarutan - Kimia Kelas 11. Ksp, larutan berada pada kondisi lewat jenuh (ada endapan). Untuk meningkatkan pemahaman Quipperian tentang materi kelarutan dan hasil kali kelarutan, simak contoh soal berikut. Contoh soal 2 Kelarutan Ag2CrO4 dalam air adalah 10-4 M. Tentukan kelarutan Ag2CrO4 dalam larutan K2CrO4 0,01 M!

The Ksp of Ag2CrO4 , AgCl, AgBr and AgI are respectively, 1.1 × 10^12, 1.8 × 10^10, 5.0 × 10
Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebag… from colearn.id Pendahuluan. Kimia adalah ilmu yang mempelajari tentang struktur, sifat, dan reaksi dari materi. Salah satu konsep penting dalam kimia adalah kesetimbangan kimia. Kesetimbangan kimia terjadi ketika reaksi berbalik dan maju dengan kecepatan yang sama.

The Ksp of Ag2CrO4 is 1.1×10−12 at 298 K. The solubility (mol/L) of Ag2CrO4 in 0.1MAgNO3
Goal. To accurately measure the solubility product constant of silver chromate. Ag2CrO4(s) ( 2 Ag+(aq) + CrO42-(aq)(Reaction One) Introduction. The solubility of a weak ionic electrolyte is measured by a specific type of equilibrium constant called the solubility product constant, Ksp. For a generic binary salt, MaXb, an equilibrium exists.

The Ksp of Ag2CrO4, AgCl, AgBr and Agl are respectively, 1.1 × 10^12, 1.8 × 10^10 , 5.0 × 10
M x A y (s) → x M y+ + y A x-. Karena zat pada tidak mempunyai molaritas, maka tetapan kesetimbangan reaksi diatas hanya melibatkan ion-ionnya saja, dan tetapan kesetimbangannya disebut tetapan hasil kali kelarutan (Ksp).. Ksp = [M y+] x [A x-] y. Hubungan Kelarutan dengan Ksp. Secara umum, hubungan antara kelarutan (s) dengan tetapan hasil kali kelarutan (Ksp) untuk larutan elektrolit A x B.

Given the two standard reduction potentials below what is the ksp of ag2cro4 at 25 °c
Jika kelarutan Ag2CrO4 dalam air adalah 5mol/Liter , tentukan hasil kali kelarutan Ag2CrO4 ! Jawab : Ag2CrO4 ⇔ 2Ag+(aq) + CrO4-2(aq) s 2s s Ksp Ag2CrO4 = […

The Ksp of Ag2CrO4 = 1.2 × 10^11 . What concentration Ag^+ ion in aqueous solution will just
The Ksp of Ag2CrO4 is 1.12× 10^-12. What is the solubility (in mol/L) of silver chromate in 1.50 M potassium chromate aq solution? In 1.50 M silver nitrate aq solution? In pure water? I'm assuming I need to write the solubility expression. If I have this right, Ksp=[2Ag]^2[CrO4] which becomes 1.12x10^-12=4s^3. But how to I then incorporate.

Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebag...
Calculate the solubility of Ag2CrO4 (Ksp = 1.31 x 10-12) a) in pure H2O b) in 0.0100 M AgNO3 c) in 0.0100 MNa2CrO4. 6 comments. Upgrade to add a comment. BP Brendan P. March 12, 2023. the answer provided seems to be option b which is 1.4410-8! but the explanation is, like kinda hard to follow could be clearer! RB.