
Buffers Contoh Soal Kumpulan Contoh Soal
Larutan Penyangga atau Larutan Buffer Asam dan Basa.Cara memahami rumus larutan penyangga asam dan basa serta perannya di dalam tubuh.Menghitung pH Larutan P.

Menghitung pH buffer setelah penambahan Asam dan Basa YouTube
Larutan buffer mempunyai komponen asam yang mampu menahan kenaikan pH dan sebuah komponen basa yang mampu menahan penurunan pH. Komponen itu merupakan konjugat dari asam basa lemah penyusun larutan buffer itu sendiri, larutan penyangga juga merupakan larutan yang dibentuk oleh reaksi asam lemah dengan basa konjugatnya ataupun basa lemah. hal ini Reaks disebut juga sebagai reaksi asam-basa.
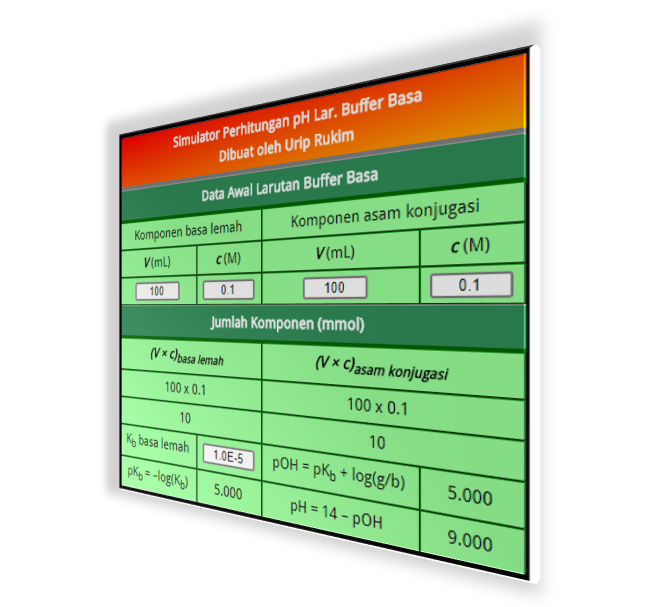
Simulator Perhitungan pH Larutan Buffer dan pH setelah Penambahan Asam/Basa Markas Belajar
Tujuan dari larutan buffer adalah untuk membantu menjaga pH stabil ketika sejumlah kecil asam atau basa dimasukkan ke dalam larutan. Larutan penyangga fosfat adalah penyangga yang praktis untuk dimiliki, terutama untuk aplikasi biologis. Karena asam fosfat memiliki beberapa konstanta disosiasi, Anda dapat menyiapkan buffer fosfat di dekat salah satu dari tiga pH, yaitu pada 2,15, 6,86, dan 12,32.

Contoh Soal Hidrolisis Dan Buffer Beserta Penjabaranya Taman Sekolah Riset
Ketika Anda membuat larutan buffer menggunakan asam lemah dan basa konjugatnya, maka larutan mempertahankan pH buffer dan dapat menahan perubahan pH tersebut dengan sedikit penambahan asam atau basa. 1. Rumus Buffer Asam. Asam lemah (HA) dan garamnya (KA) dalam larutan penyangga asam dengan basa kuat (KOH).

Kimia Kelas 11 Asam dan Basa (Menentukan pH campuran) YouTube
Buffer Asam atau penyangga asam adalah campuran Asam Lemah dan Basa Konjugasinya (Garamnya). Contoh: C H 3 C O O H - C H 3 C O O K C H 3 C O O H - C H 3 C O O N H 4 (bukan buffer) (C H 3 C O O) 2. C a - C H 3 C O O H. HCl - NaCl (bukan buffer). Rumus Buffer Asam ( PH < 7) LARUTAN PENYANGGA ATAU LARUTAN BUFFER | BIMBEL-Q.COM. LARUTAN.

Inilah Contoh Soal Menghitung Ph Larutan Buffer Terbaru Daftar Contoh Soal 2022
Kalau pakai teknik "The Tereh". Cukup pakai rumus: [H +] = 0,5 x 10 -5. [H +] = 5 x 10 -6. pH = 6 - log 5. Hasilnya sama tanpa harus ribet direaksikan. Rumus ini bisa dipakai kalau jumlah H di asam sama dengan jumlah OH di basa. Contoh HCl, jumlah H nya satu bereaksi sama NH 4 OH, OH nya juga satu. atau yang sama-sama 2 jumlah H atau OH nya.
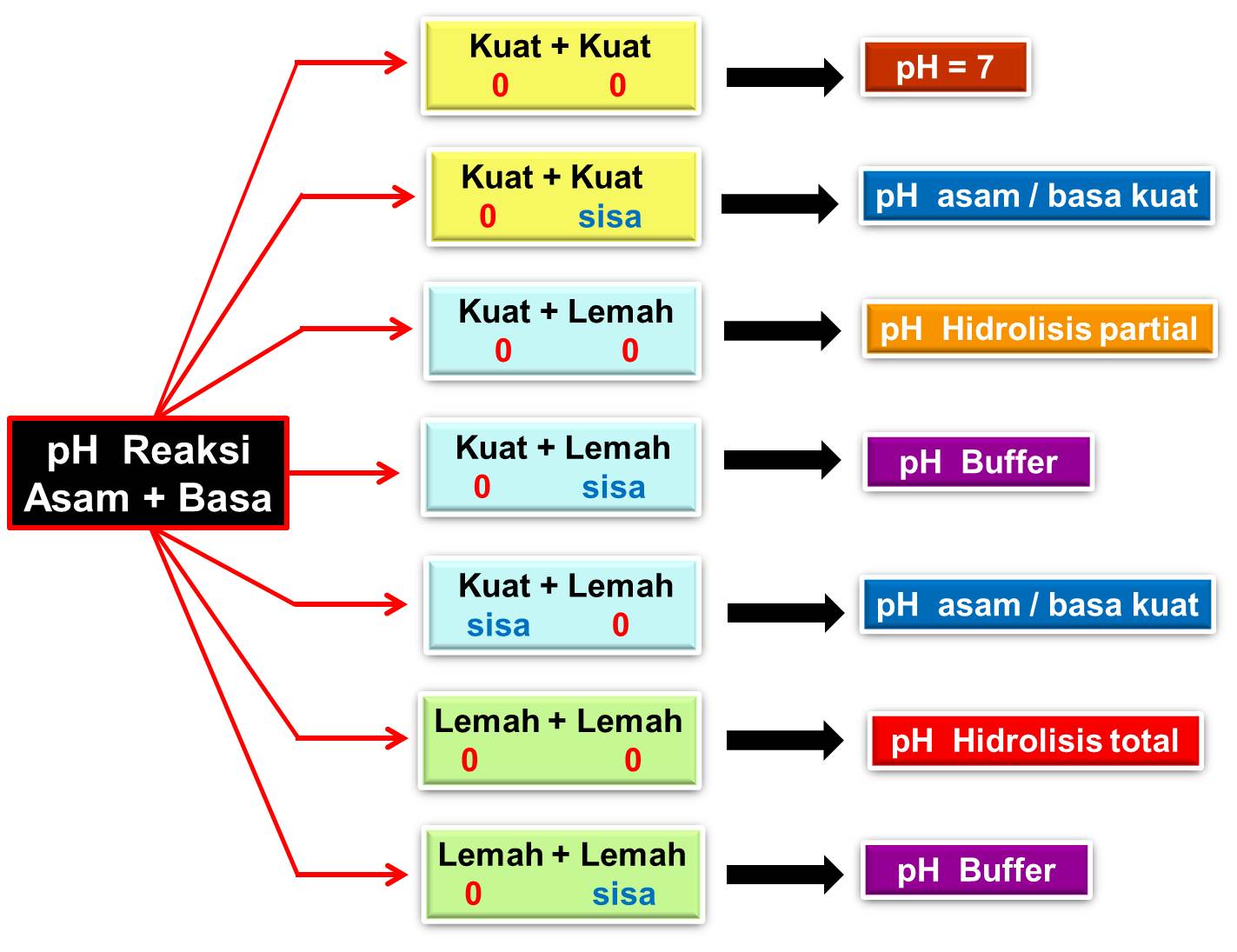
CINTA KIMIA PH REAKSI ASAM DAN BASA
Setelah diketahui konsentrasi H +, maka pH dapat dihitung dengan rumus:. pH = - log [H +] = - log (1.76 x 10-5) = 4.75. Jadi pH larutan buffer yang dibuat dari 1 M asam asetat dan 1 M natrium asetat yaitu sebesar 4.75.
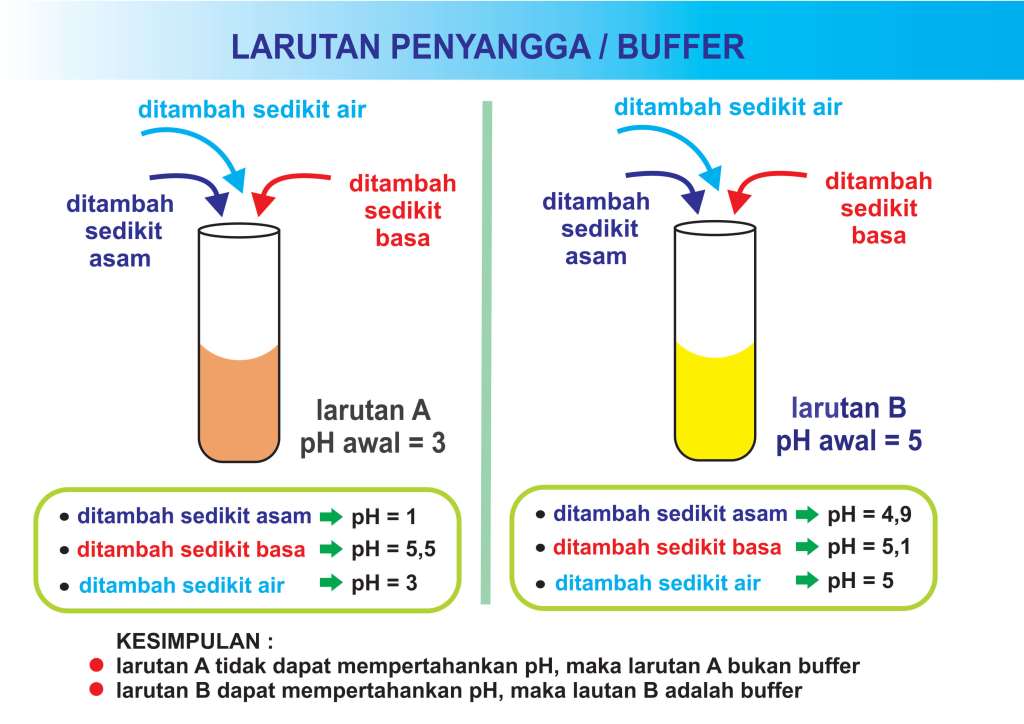
√ Larutan Penyangga / Buffer Pengertian, Rumus, dan Contoh Soal
pH Larutan Penyangga Larutan penyangga asam. Dalam larutan buffer asam yang mengandung CH 3 COOH dan CH 3 COO −, terdapat kesetimbangan:. CH 3 COOH(aq) ⇌ CH 3 COO − (aq) + H + (aq). Setelah disusun ulang, persamaan pH larutan di atas akan menjadi persamaan larutan penyangga yang dikenal sebagai persamaan Henderson - Hasselbalch sebagaimana persamaan berikut ini:

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
Kapasitas bufer (𝛽) dapat didefinisikan sebagai jumlah asam kuat atau basa kuat yang ditambahkan ke dalam 1 liter larutan penyangga yang menyebabkan perubahan pH sebesar 1 satuan: β = Δcb ΔpH = − Δca ΔpH. atau dapat menyesuaikan dengan data yang diketahui dihitung dengan menggunakan persamaan Van Slyke: β = 2, 303 × (ca +cb).Ka.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
Cara kedua ini harus menghasilkan sisa dari asam lemah atau basa lemah. Dari persamaan tersebut, CH 3 COOH (asam lemah) dan NH 3 (basa lemah) masih tersisa, sedangkan NaOH dan HCl habis bereaksi.. Jadi, garam yang terbentuk dari CH 3 COONa mengandung basa konjugasi. Sedangkan garam dari NH 4 Cl mengandung asam konjugasi.. Jenis-Jenis Larutan Buffer dan Cara Kerjanya

Chemical Analyst pH Larutan ( Menentukan Rumus Yang Akan Dipakai Untuk Mencari pH Suatu Larutan
Pengertian Larutan Penyangga. Seperti yang sudah disinggung di awal, larutan penyangga adalah larutan yang yang mampu mempertahankan pH-nya saat ditambahkan asam, basa, maupun air. Larutan buffer menjadi salah satu produk yang dihasilkan dari reaksi asam dan basa. Larutan buffer terbentuk dari interaksi antara asam atau basa lemah dengan.

Cara Menghitung pH Larutan Asam, Basa, Garam Beserta Contoh Soal dan Pembahasan
The ASAM Criteria defines the standards for conducting a comprehensive biopsychosocial assessment to inform patient placement and treatment planning. These standards describe six dimensions that should be assessed, including: Emotional, behavioral, and cognitive conditions and complications. The ASAM Criteria also provides standards for rating.

Baru 28+ Rumus Ph
Berdasarkan asam basa penyusunnya, larutan buffer dibedakan menjadi 2, yakni sebagai berikut : 1. Larutan buffer asam. Larutan buffer asam yaitu larutan penyangga yang terbentuk dari asam lemah dan basa konjugasinya. Larutan penyangga asam mempunyai pH kurang dari 7. Contoh: CH₃COOH (asam lemah) dan CH₃COO- (basa konjugasinya). 2.

PPT KESETIMBANGAN ASAMBASA PowerPoint Presentation, free download ID4181029
Larutan penyangga adalah larutan yang mampu mempertahankan derajat keasaman (pH) pada saat asam atau basa dimasukkan dalam suatu larutan. Larutan penyangga disebut juga "buffer" atau "penahan". Berikut ini yang termasuk dalam larutan buffer. 1. Campuran asam lemah dengan garam yang berasal dari asam lemah tersebut. Contoh : CH 3 COOH.

27+ Contoh Soal Hidrolisis Asam Lemah Basa Lemah Contoh Soal Terbaru
Hubungan antara pH dan pOH adalah : pH + pOH = pKw. dimana Kw adalah konstanta disosiasi air (menghasilkan H + dan OH −) yang bernilai 10 − 14, sehingga persamaan di atas menjadi. pH + pOH = 14. Suatu larutan akan bersifat asam bila jumlah H + lebih besar dari jumlah OH −, sehingga pada kondisi netral, pH = pOH = 7.

Cara Menghitung Ph Asam Lemah Satu Manfaat
a. Larutan penyangga asam. Larutan buffer asam mempertahankan pH pada suasana asam (pH < 7). Larutan buffer asam terdiri dari komponen asam lemah (HA) dan basa konjugasinya (A−). Larutan seperti ini dapat diperoleh dengan: mencampurkan asam lemah (HA) dengan garam basa konjugasinya (LA, yang dapat terionisasi menghasilkan ion A−)