
Mengenal Rumus Ph Beserta Contoh Soal Dan Cara Menghitungnya Kumparan Unamed
Penambahan basa (OH −): ion OH − dari asam yang ditambahkan akan bereaksi dengan komponen asam konjugasinya. Misal larutan buffer basa NH3 / NH + 4: NH3 + H + ⇄ NH + 4 NH + 4 + OH − → NH3 + H2O. -. pengenceran: pada pengenceran hanya memperbesar volume komponen-komponen larutan penyangga.

pH campuran dari 20 mL larutan CH3COOH 0,3 M(Ka=1 x 10...
tidak melakukan eliminasi. Fungsi utama sistem buffer adalah mencegah perubahan pH yang disebabkan oleh pengaruh asam fixed dan asam organic pada cairan ekstraseluler. Sebagai buffer, sistem ini memiliki keterbatasan yaitu4: a. Tidak dapat mencegah perubahan pH di cairan ekstraseluler yang disebabkan karena peningkatan CO 2. b.
Contoh Soal Ph Larutan Penyangga
pH campuran yang tidak akan berubah oleh pengaruh pengenceran adalah. a. CH3COOH (aq) + NH4Cl (aq) b.. Apakah semua campuran antara asam lemah basa konjugatnya. Tonton video. Tuliskan komposisi yang dapat membentuk: a. larutan penya. Tonton video. Jelaskan pengertian, sifat, dan fungsi larutan penyangga! Tonton video.

Hitunglah Ph Larutan Yang Terbentuk Dari Campuran Berikut B Ml Hot Sex Picture
Nilai pH air dari yang tadinya sesuai bagi makhluk hidup di dalamnya akan berubah akibat zat pencemar tersebut. Oleh karena itu, penting untuk mencegah dan mengendalikan faktor yang mempengaruhi pH air agar tetap terjaga kualitasnya. Berikut ini adalah faktor-faktor yang mempengaruhi pH air: Konsentrasi CO 2 dalam air

pH Campuran asam Lemah dan Asam KuatKimia SMA YouTube
Karena adanya sistem penyangga air liur, maka cairan dalam mulut kita akan memiliki pH berkisar 6,8. Sistem penyangga yang ada dalam air liur kita adalah penyangga fosfat. Fosfat merupakan campuran dari H2PO4- dan HPO 4 2- . Apabila terjadi peningkatan zat asam, maka reaksi yang terjadi adalah HPO 4 2- + H + → H2PO4-.

Hitunglah pH campuran antara 200 mL larutan HNO2 0,15 M dengan 150 mL larutan KOH 0,10 M (Ka
Istilah "pH" berasal dari kata Jerman "potenz," yang berarti "pangkat" , dikombinasikan dengan H, simbol unsur untuk hidrogen, jadi pH adalah singkatan dari "pangkat hidrogen.". Pengertian pada umumnya, pH (Power of Hydrogen) adalah skala yang digunakan untuk menyatakan tingkat keasaman atau kebasaan yang dimiliki oleh suatu larutan.. Skala dari pH terdiri dari angka 1 hingga

Identifikasi Asam Basa
Setiap pengenceran 100 kali dari volume semula maka pH berubah 2 satuan pH. Setiap pengenceran 1000 kali dari volume semula maka pH berubah 3 satuan pH. Setiap pengenceran 10.000 kali dari volume semula maka pH berubah 4 satuan pH. Demikian seterusnya tetapi tidak akan pernah melewati pH 7 dan hanya mendekati 7 atau hampir 7. Contoh Perhitungan.

Hitunglah pH campuran antara 200 mL larutan HNO2 0,15 M dengan 150 mL larutan KOH 0,10 M (Ka
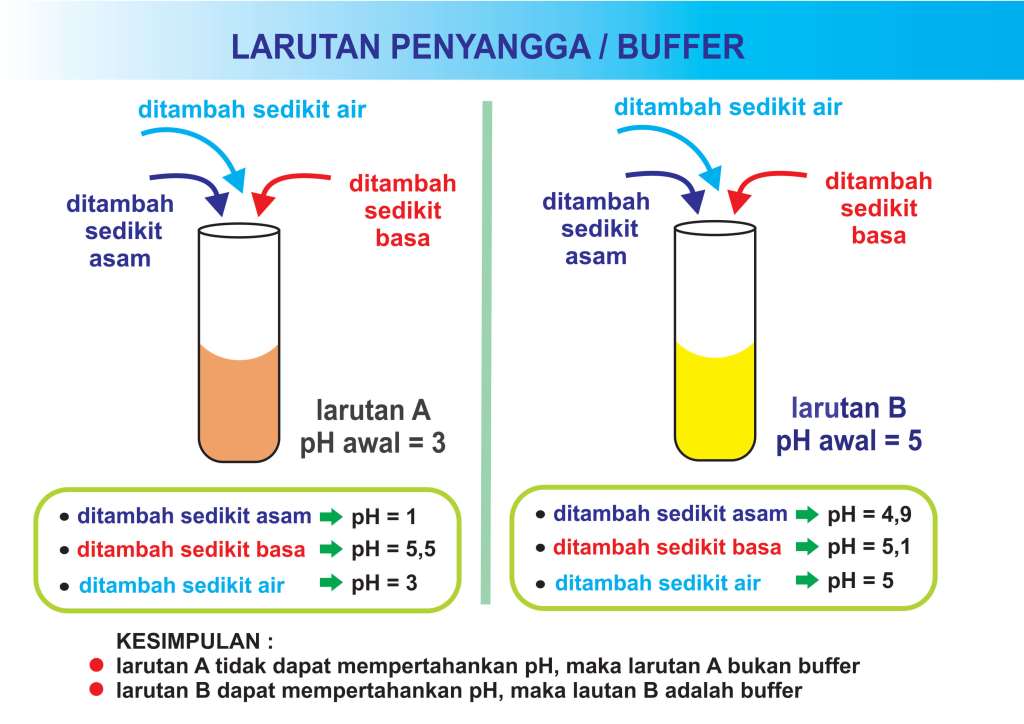
Halo Shalma, Kakak bantu jawab ya. Jawaban yang benar adalah D. Larutan penyangga adalah suatu sistem larutan yang dapat mempertahankan nilai pH larutan agar tidak terjadi perubahan pH yang berarti oleh karena penambahan asam atau basa maupun pengenceran. Larutan ini disebut juga dengan larutan buffer atau dapar. Komponen Larutan Penyangga: 1.

Pasangan campuran larutan yang dapat membentuk larutan pe...
Iklan. Pertanyaan. pH campuran berikut yang tidak akan berubah oleh penambahan sedikit asam atau basa adalah. asam asetat dengan amonium klorida. asam asetat dengan natrium klorida. asam sulfat dengan natrium sulfat. asam asetat dengan amonium sulfat. asam asetat dengan natrium asetat. Iklan.

Kimia Kelas 11 Asam dan Basa (Menentukan pH campuran) YouTube
Jadi, pH larutan penyangga setelah pengenceran sebesar 9,26. Dari contoh soal di atas dapat dibuktikan bahwa pengenceran tidak mempengaruhi nilai pH larutan penyangga. Perubahan pH larutan penyangga oleh penambahan sedikit asam kuat atau basa kuat kecil sekali, sehingga pH larutan penyangga dianggap tidak berubah.

Data trayek pH dan perubahan warna indikator ditunjukkan
Pembahasan. Suatu larutan yang tidak akan berubah pHnya meskipun diencerkan adalah larutan penyangga. Larutan penyangga terdiri dari asam/basa lemah dan garam atau konjugatnya. Makan pasangan yang sesuai adalah . Campuran kedua senyawa tersebut dapat membuat larutan penyangga.

Menghitung pH Campuran Asam Kuat dan Basa Kuat ( Asam Basa Kimia SMA Kelas 11 ) YouTube
Jika campuran tersebut diencerkan, maka harga perbandingan komponen-komponennya tidak berubah sehingga pH larutan juga tidak berubah. Secara teoritis, berapapun tingkat pengenceran tidak akan merubah pH. Akan tetapi dalam praktiknya, jika dilakukan pengenceran yang berlebihan, maka pH larutan penyangga akan berubah. V 1 M 1 =V 2 M 2. Keterangan:
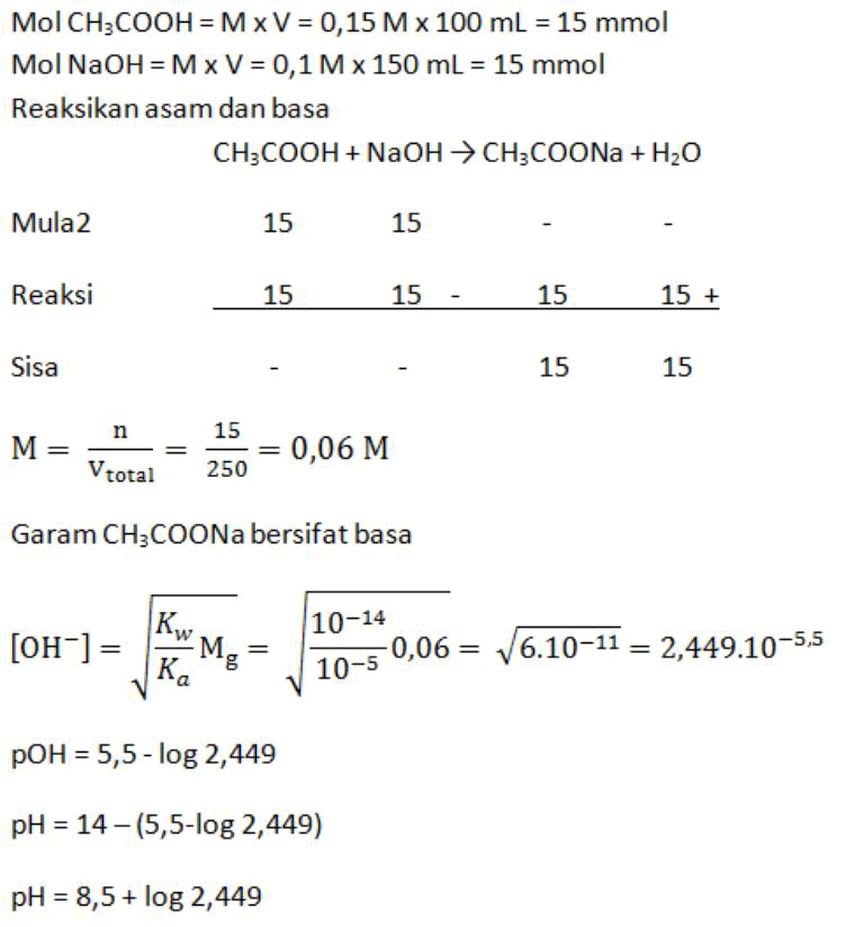
Larutan CH3COOH 0,15 M yang volumenya 100 mL dicampur dengan 150 mL larutan NaOH 0,1 M (Ka
Dari penjelasan di atas, dapat kita simpulkan bahwa larutan penyangga adalah larutan yang mampu mempertahankan pH tertentu dari bahan yang mengubah pH, seperti penambahan asam, basa, ataupun pengenceran. Jadi pH larutan penyangga tidak akan berubah meski ditambah asam kuat, basa kuat, atau larutan yang diencerkan.

PH PENGENCERAN DAN CAMPURAN YouTube
Di dalam cairan lambung ini, yang bertindak sebagai larutan penyangga ternyata sangat kompleks, lho. Salah satu contohnya adalah campuran ion bikarbonat (HCO 3 -) dan ion karbonat (CO 3 2-). Campuran ini dapat mencegah perubahan pH yang drastis pada lambung, sehingga mencegah kerusakan lambung akibat pH makanan yang berubah-ubah. Misalkan.

Soal Pembahasan Larutan Penyangga Buffer Reaksi Asam Basa Lemah Dan Hot Sex Picture
P asangan larutan yang pH-nya tidak akan berubah apabila ditam bah sedikit. sehingga pH campuran = 8 adalah. a. 66 gr. b. 33 gr. c. 13,2 gr. a. pH larutan penyangga berubah oleh.

pH larutan setelah penambahan H2SO4 dan pengenceran adalah Brainly.co.id
Larutan penyangga memiliki pH yang konstan, terhadap pengaruh pengenceran atau ditambah sedikit asam atau basa. Secara teoritis berapa pun diencerkannya pH tidak akan berubah, tetapi dalam praktiknya jika pengenceran besar sekali, jelas pH-nya akan berubah.. Bila 50 mL larutan NH4OH 0,2 M dicampurkan ke dalam 50 mL larutan HCl 0,1 M. Hitung.