
perbedaan senyawa ion dan kovalen polar Carolyn Simpson
Kaidah oktet (aturan oktet) adalah suatu kaidah sederhana dalam kimia yang menyatakan bahwa atom-atom cenderung bergabung bersama sedemikiannya tiap-tiap atom memiliki delapan elektron dalam kelopak valensinya, membuat konfigurasi elektron atom tersebut sama dengan konfigurasi elektron pada gas mulia.Kaidah ini dapat diterapkan pada unsur-unsur golongan utama, utamanya karbon, nitrogen.

Bentuk Molekul Dari Senyawa Yang Terjadi Jika Kedua Unsur Tersebut Berikatan Sesuai Aturan Oktet
Oktet terekspansi terjadi pada unsur-unsur periode 3 atau lebih yang dapat menampung lebih dari 8 elektron valensi pada kulit terluarnya (perlu kalian ingat bahwa kulit M dapat menampung hingga 18 elektron). Beberapa contoh senyawa yang mengalami oktet terekspansi adalah PCl 5, SF 6, ClF 3, IF 7 dan SbCl 5.

Perhatikan gambar struktur Lewis beberapa senyawa berikut...
Kaidah oktet adalah aturan yang menyatakan bahwa atom-atom paling stabil ketika kulit terluarnya (kulit valensi) memiliki delapan elektron. Itu artinya, atom-atom yang memiliki elektron kurang dari delapan pada kulit terluarnya akan cenderung membentuk ikatan dengan atom-atom yang lain untuk mencapai kaidah oktet.

Senyawa Yang Struktur Elektronnya Tidak Memenuhi Kaidah Oktet Adalah pohon dadap daun dadap serep
Karena pada ikatan kimia yang berinteraksi adalah elektron valensi, maka kita akan pahami terlebih dahulu mengenai simbol lewis serta aturan duplet dan oktet di bawah ini.Jika kamu sudah paham kamu bisa langsung ke jenis-jenis ikatan kimia ya! [inline_ads] B. Simbol Lewis, Aturan Oktet, dan Aturan Duplet
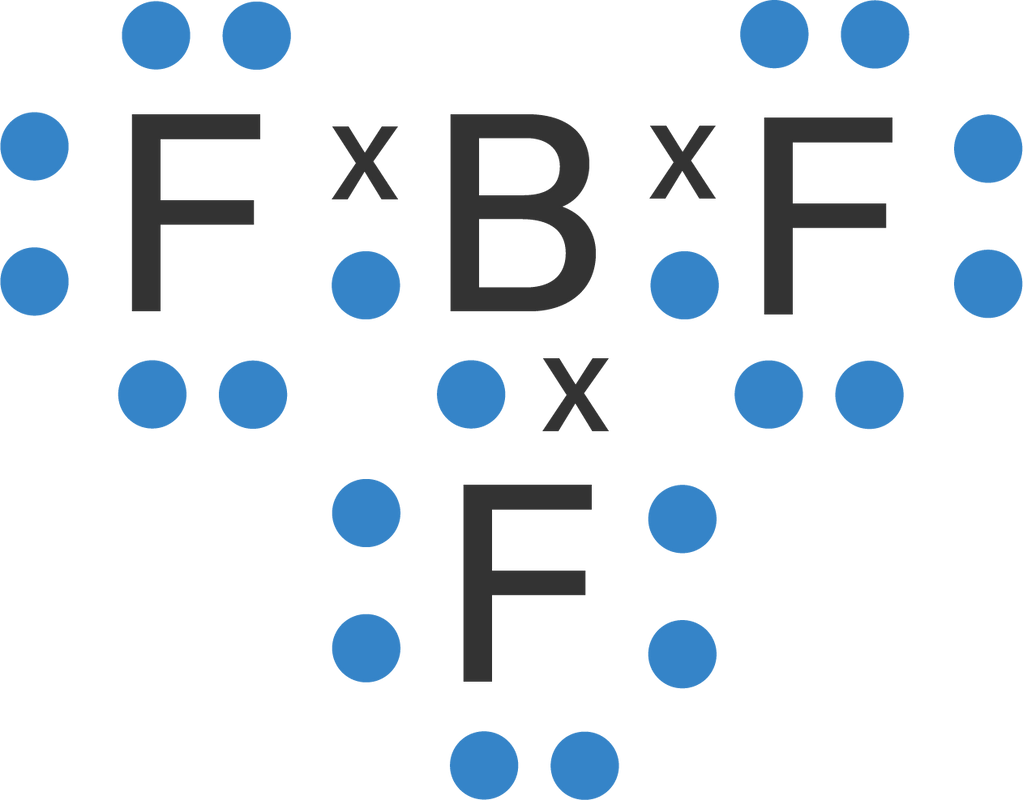
Diketahui 5 B , 9 F , 14 Si , 16 S , 54
Ini adalah definisi aturan oktet dalam kimia dan ringkasan singkat tentang sejarah di baliknya. Menu. Rumah. Sains, Teknologi, Matematika Sains matematika Ilmu Sosial Ilmu Komputer Hewan & Alam Sastra. Ini adalah struktur Lewis karbon dioksida, yang menggambarkan aturan oktet.

Aturan Oktet YouTube
Tetapi ada beberapa senyawa yang mengalami penyimpangan oktet, diantaranya adalah sebagai berikut. 1. Senyawa yang tidak mencapai oktet (∑e<8) Senyawa yang atom pusatnya memiliki jumlah elektron valensi <4, seperti Be, B, dan Al, menyebabkan terbentuknya ikatan kimia yang belum mencapai oktet. Hal tersebut dinamakan oktet tak lengkap. Contoh.

Penyimpangan Kaidah Oktet LEMBAR EDU
KOMPAS.com - Aturan oktet adalah suatu kaidah sederhana dalam kimia yang menyatakan bahwa atom dari kelompok unsur utama cenderung berikatan dengan atom lain.. Aturan oktet sangat berguna untuk memprediksi rumus kimia senyawa biner sederhana. Aturan oktet dapat diterapkan pada unsur-unsur golongan utama.

Penyimpangan Kaidah Oktet dan Contoh Soal Bisakimia
Pengecualian untuk Aturan Oktet. Diperbarui pada 03 Agustus 2019. Aturan oktet adalah teori ikatan yang digunakan untuk memprediksi struktur molekul molekul yang terikat secara kovalen. Menurut aturan, atom berusaha untuk memiliki delapan elektron di kulit terluarnya—atau valensi—elektron. Setiap atom akan berbagi, mendapatkan, atau.

Senyawa Yang Struktur Elektronnya Tidak Memenuhi Kaidah Oktet Adalah pohon dadap daun dadap serep
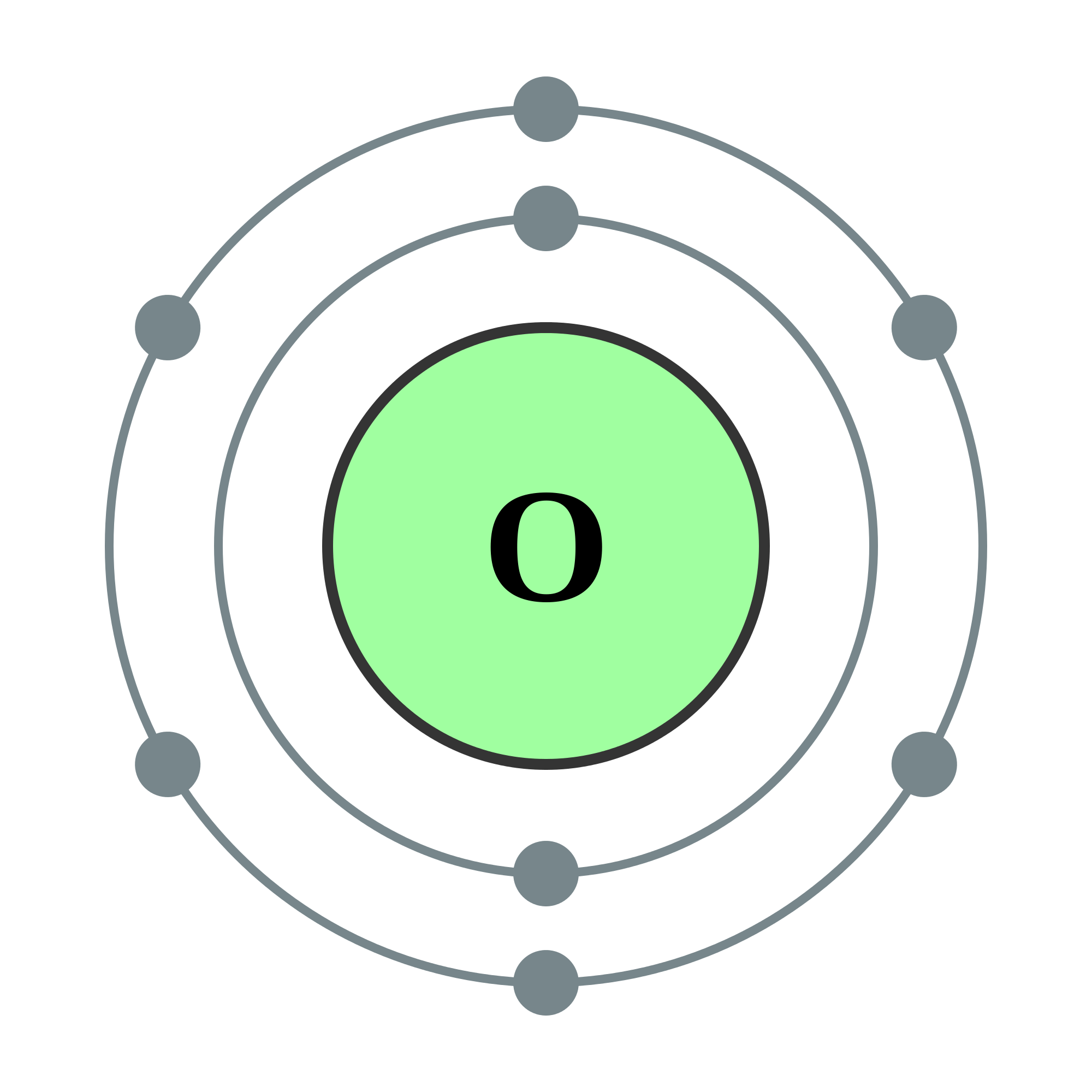
Gas mulia yang memiliki susunan elektron valensi tidak sesuai aturan oktet adalah… Jawaban: Ada enam unsur dalam golongan gas mulia, yaitu helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn). Untuk mengetahui apakah unsur-unsur tersebut memenuhi aturan oktet, kita harus menentukan konfigurasi elektronnya: [He]: 2 [Ne.
Octet Rule Valence Electrons Of Oxygen Exceptions to the Octet Rule jehomewithanh
Ikatan kimia adalah gaya yang mampu mengikat atom-atom pada molekul atau gabungan ion pada suatu senyawa. Ikatan kimia terbentuk karena setiap atom memiliki kecenderungan untuk memiliki susunan elektron yang stabil seperti gas mulia yang memiliki elektron di kulit terluar (elektron valensi) berjumlah dua/duplet dan berjumlah 8/oktet.

(PPT) Kaidah Oktet Adrian H Academia.edu
1. Ikatan Kovalen Rangkap Dua. Ikatan ini dibentuk oleh atom-atom nonlogam yang menyumbangkan dua elektron tidak berpasangan untuk berikatan sehingga memenuhi kaidah. Berikut ini beberapa contoh yang memliki kovalen berangkap dua: a. Struktur Lewis Molekul O2. Dalam atom O terdapat dua elektron yang tidak berpasangan.

Cara Mudah Menggambar Struktur Lewis Penyimpangan Kaidah Oktet YouTube
Sebagai contoh adalah senyawa belerang berupa sulfur heksafluorida (SF6). SF6 terbentuk dari enam atom fluor yang berikatan dengan satu atom belerang. Dilansir dari Chemistry LibreTexts , fluor memiliki oktet tetapi atom belerang memiliki 12 elektron yang mengelilinginya (bukan 8 seperti aturan oktet).

Penyimpangan dan kesesuaian dengan kaidah Oktet dan DupletKimia SMA YouTube
Aturan oktet dapat diterapkan pada unsur-unsur golongan utama, seperti karbon, nitrogen, oksigen, dan halogen. Aturan ini juga dapat diterapkan pada unsur logam seperti natrium dan magnesium. Suatu unsur dapat mencapai kestabilan dengan beberapa cara, yaitu melepaskan elektron dan menerima atau menangkap elektron.

Senyawa Yang Struktur Elektronnya Tidak Memenuhi Kaidah Oktet Adalah pohon dadap daun dadap serep
Pengertian Aturan Oktet. Aturan oktet adalah aturan yang menyatakan bahwa atom dari kelompok unsur utama cenderung berikatan dengan atom lain dengan cara memberi ataupun menerima elektron sedemikian rupa sehingga atom yang berikatan memiliki delapan elektron di kulit terluarnya. Sehingga konfigurasi elektron yang didapat akan sama dengan gas.

materi kimia kaidah oktet dan duplet part 1 YouTube
Aturan Oktet Adalah. Aturan oktet adalah sebuah kaidah sederhana yang ada dalam kimia yang menyatakan bahwa atom-atom cenderung bergabung bersama sedemikiannya tiap-tiap atom memiliki delapan elektron dalam kelopak valensinya, membuat konfigurasi elektron atom tersebut sama dengan konfigurasi elektron pada gas mulia.. Baca Juga : Senyawa Kovalen Polar dan Non Polar Kimia

Penyimpangan Kaidah Oktet LEMBAR EDU
Aturan oktet gagal meramalkan rumus kimia senyawa dari unsur transisi maupun postransisi. Unsur postransisi adalah unsur logam setelah unsur transisi, misalnya Ga, Sn, dan Bi. Sn mempunyai 4 elektron valensi, tetapi senyawanya lebih banyak dengan tingkat oksidasi +2.