
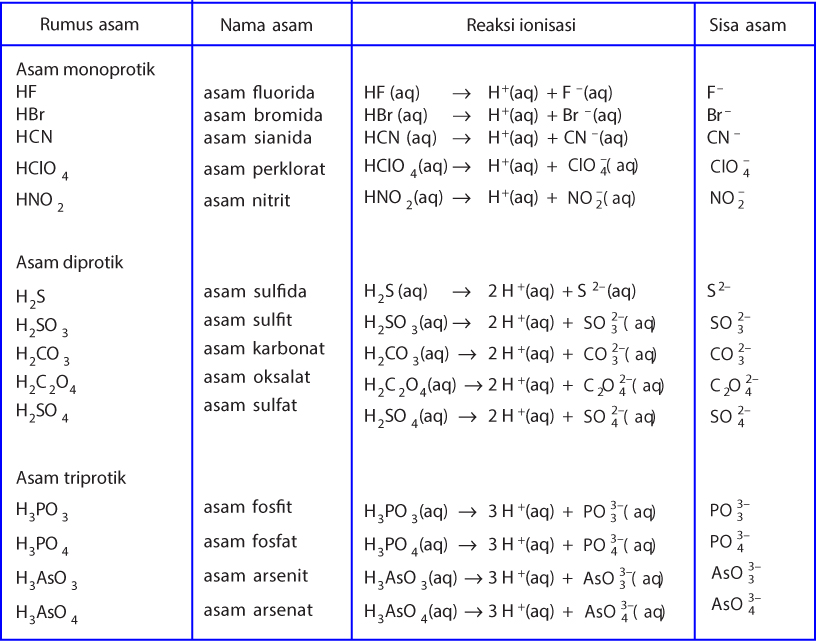
Teori Asam Basa
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
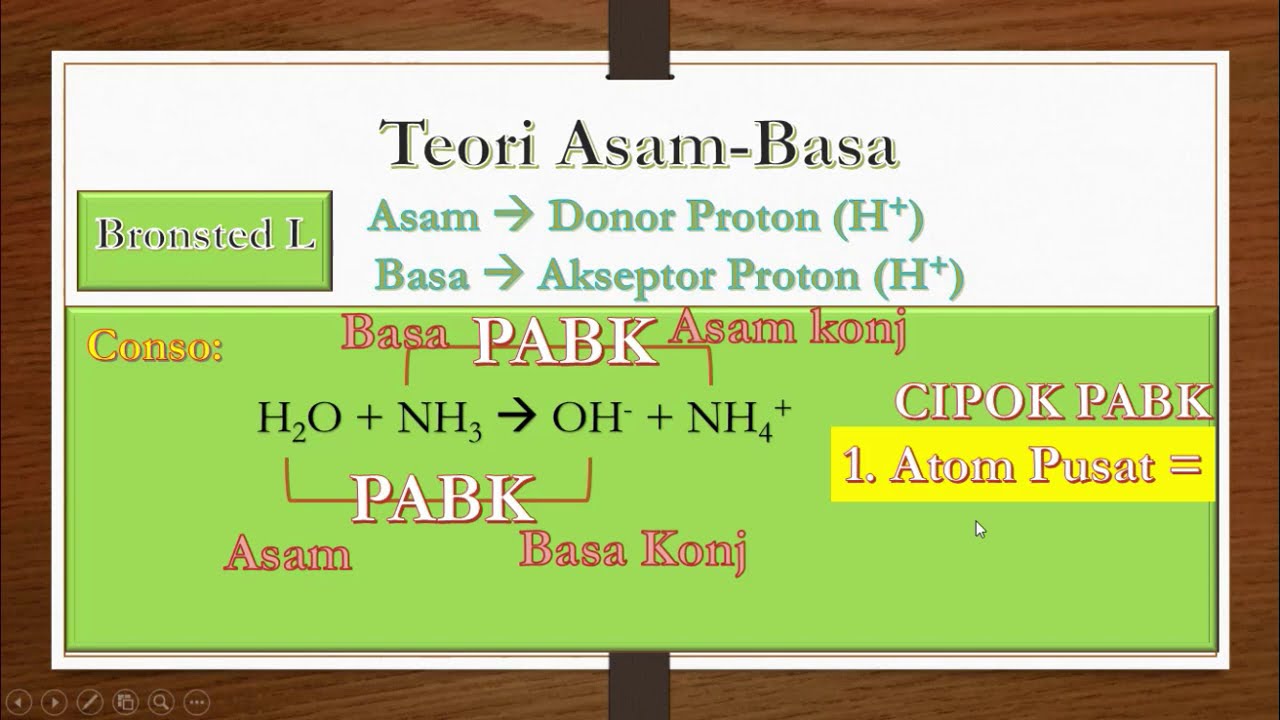
Menurut Teori Bronsted Lowry, asam adalah substansi yang mampu menyumbangkan atau melepaskan ion H+ (proton), sedangkan basa adalah substansi yang mampu menerima ion H+. Dengan kata lain, dalam reaksi kimia, asam akan melepaskan proton dan basa akan menerima proton. Contoh paling sederhana dari reaksi ini adalah reaksi antara asam klorida (HCl.

Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
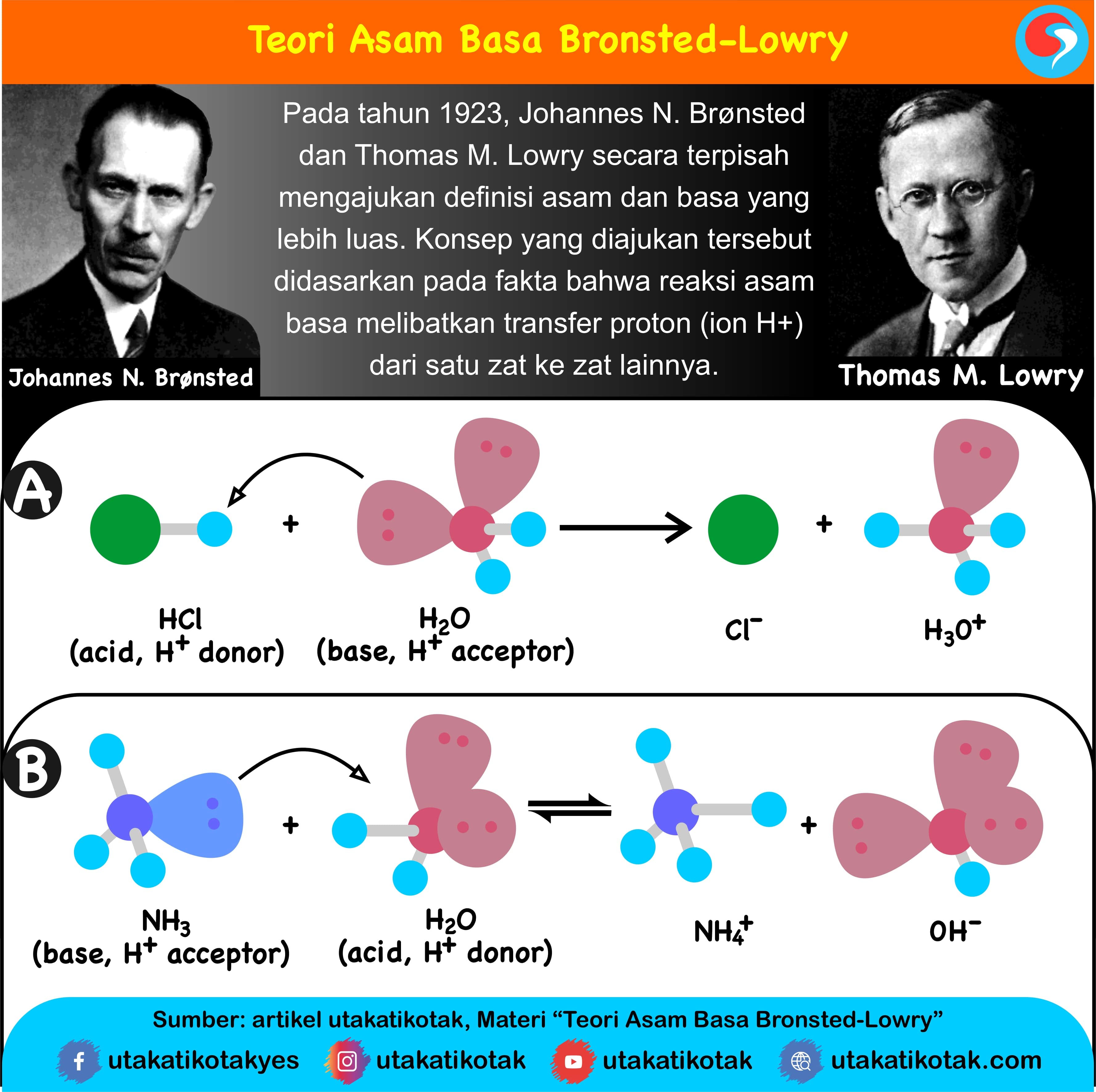
11 Januari 2024. jelaskan pengertian asam basa menurut bronsted lowry - Pengertian asam basa menurut Bronsted-Lowry adalah konsep asam basa yang paling dikenal dan paling sering digunakan dalam kimia. Konsep ini pertama kali diperkenalkan oleh dua ahli kimia, Johannes Bronsted dan Thomas Lowry pada tahun 1923.

Asam Basa Kelas 11 Konsep Bronsted Lowry YouTube
Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy , asam mengandung hidrogen yang dapat berdisosiasi menjadi H+, sedangkan basa harus memiliki setidaknya satu pasang elektron bebas untuk dapat menerima donor.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Bronsted-Lowry also states that if an acid gives protons (H+), then the rest of the acid has the ability to act as a base. The rest of the acid is expressed as conjugated bases. Similarly, for bases, if a base can receive protons (H+), then the substance formed has the ability as an acid called conjugated acid.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Terdapat beberapa karakteristik khas yang membedakan asam dan basa menurut teori Bronsted-Lowry: 1. Asam: - Asam dapat melepaskan ion H+. - Asam bersifat korosif dan dapat menyebabkan iritasi pada kulit. - Contoh asam umum meliputi asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). 2.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
Konsep mudah belajar teori asam basa Bronsted-Lowry . dimana asam adalah pemberi proton . sedangkan Basa adalah penerima proton. terdiri dari asam basa konj.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
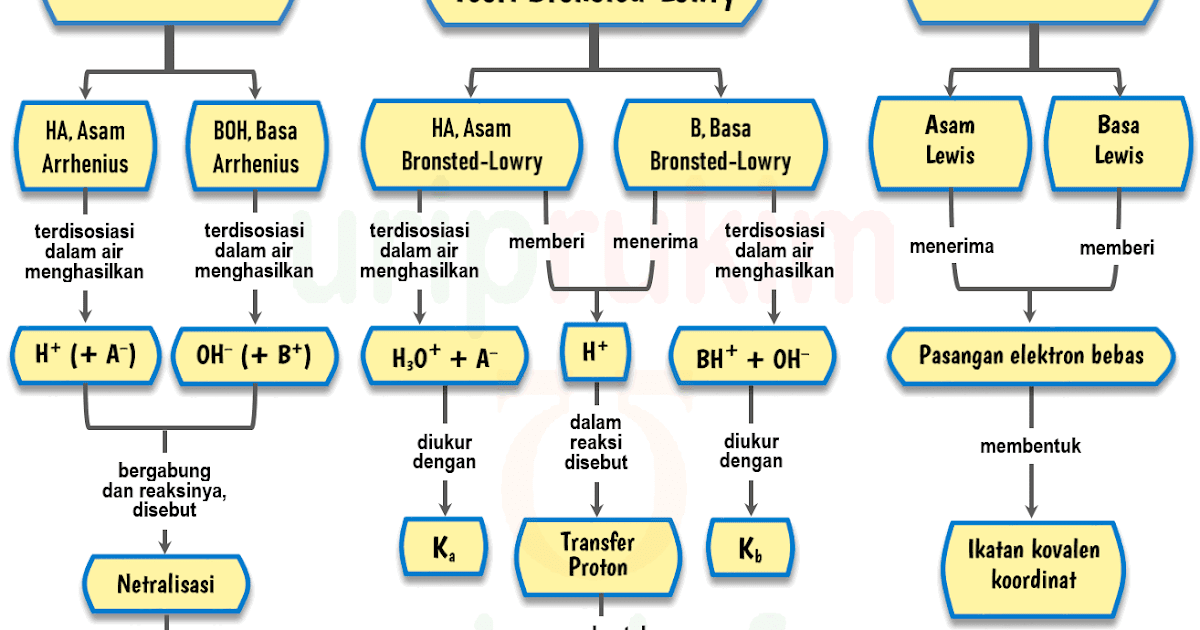
Reaksi ionisasi basa Arrhenius . 2. Teori Asam Basa Bronsted- Lowry. Pada tahun 1923 Johannes N. Bronsted dan Thomas M. Lowry mengajukan konsep asam basa berdasarkan pemindahan proton (H +) Berikut ini asam basa menurut Bronsted-Lowry: Asam adalah spesi yang dapat memberikan proton atau donor proton (H +)
Teori Asam Basa Arrhenius bronsted lowry Larutan Asam Basa YouTube
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
Pembahasan. Johannes Bronsted dan Thomas Lowry secara terpisah mengusulkan bahwa yang berperan dalam memberikan sifat asarn dan basa suatu larutan adalah ion atau proton. Menurut teori Bronsted-Lowry, asam adalah spesi kimia (ion atau molekul) yang berperan sebagai proton donor (pemberi proton) kepada suatu spesi yang lain.

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Contoh Penggunaan Konsep Asam dan Basa Menurut Bronsted Lowry dalam Kehidupan Sehari-hari. Konsep asam dan basa menurut Bronsted Lowry memiliki banyak contoh penggunaan dalam kehidupan sehari-hari. Salah satu contoh yang paling umum adalah dalam pembuatan dan penggunaan produk-produk kimia seperti deterjen, sabun, dan produk pembersih lainnya.

Teori Asam Dan Basa Menurut Arrhenius Bronsted Lowry Dan Lewis Ezy Blog My XXX Hot Girl
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.
Teori Asam dan Basa Menurut BronstedLowry
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Teori Asambasa BronstedLowry YouTube
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Basa
Konsep asam basa dapat dijelaskan melalui tiga konsep, yaitu konsep Arrhenius, Bronsted-Lowry, dan Lewis. Konsep Arrhenius menjelaskan sifat asam-basa dalam air. Menurut konsep Arrhenius, asam adalah zat yang dapat melepaskan ion hidrogen (H+) ketika dilarutkan dalam air.