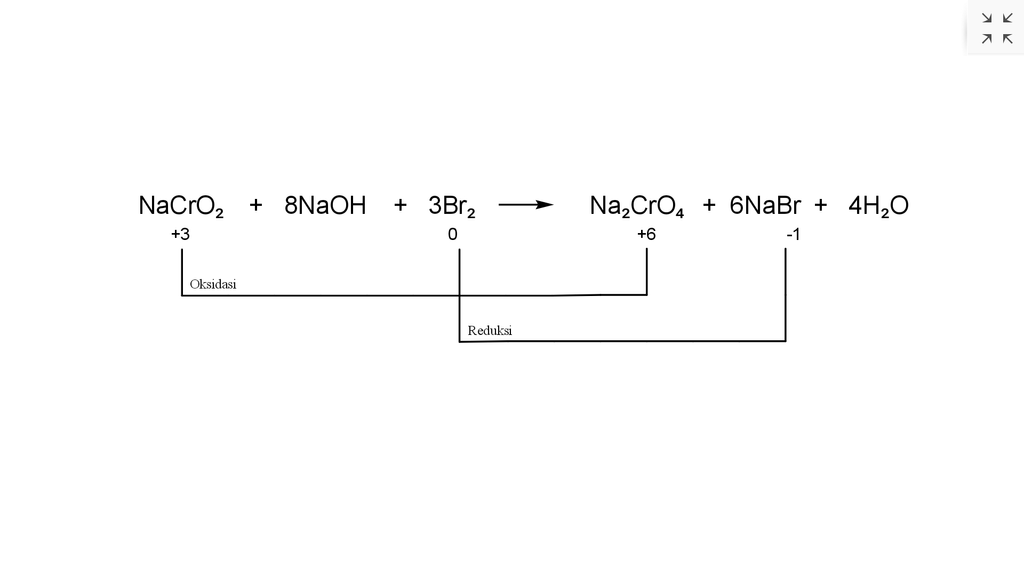
Tentukan perubahan bilangan oksidasi yang terjadi
Oksidasi adalah ketika suatu zat mengalami arus listrik, maka akan terjadi pelepasan elektron (), sehingga jumlah bilangan oksidasi (biloks)-nya akan naik. Bilangan Oksidasi (Biloks) Nah, hal lain yang perlu elo tau saat mempelajari materi reaksi redoks adalah bilangan oksidasi atau biloks. Biloks itu apaan, sih? "Bilangan oksidasi adalah.

Cara Menentukan Bilangan Oksidasi yang Mudah, Berikut Penjelasannya
Misalnya biloangan oksidasi Mn pada senyawa MnO 2 berbeda dengan Mn pada MnO.. Berdasarkan Perubahan Bilangan Oksidasi.. Biloks Fe = 6/2 = +3. Jadi, yang merupakan reaksi oksidasi adalah FeO (biloks Fe mengalami kenaikan dari +2 menjadi +3) Dan yang mengalami reaksi reduksi adalah O 2 (biloks O menurun dari 0 menjadi -2).
bilangan oksidasi zat yang bertindak sebagai reduk...
Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Aturan Penentuan Bilangan Oksidasi. Setelah memahami pengertian, Sobat Zenius juga harus tahu aturan biloks. Aturan yang menentukan bilangan oksidasi yang benar adalah: Unsur Bebas → Biloks = 0. Contoh: Na, K, Cl 2, M 2, dan O 2. Logam yang Berikatan dengan Unsur Lain → Biloks = Positif. Contoh: Gol I: Na, K, Rb → biloks = +1

Cara Menentukan Bilangan Oksidasi Matob
Namun, jika bilangan oksidasinya menurun dari sebelum reaksi hingga setelah reaksi maka spesies tersebut dikatakan mengalami reduksi. Bilangan oksidasi juga berguna dalam penyetaraan persamaan reaksi kimia redoks. Tujuannya yaitu memastikan jumlah total elektron yang hilang dalam oksidasi sama jumlahnya dengan elektron yang diperoleh melalui.

Bilangan oksidasi Mn tertinggi terdapat pada senyawa....
Beberapa aturan penentuan bilangan oksidasi adalah sebagai berikut. Jumlah biloks senyawa netral sama dengan 0; Bilangan oksidasi atom dalam senyawa adalah -2, kecuali pada senyawa peroksida dan senyawa superoksida; Bilangan oksidasi atom dalam senyawa adalah -1 , kecuali pada senyawa asam oksihalida.; Sehingga biloks Mn dalam senyawa yaitu:

Cara Menentukan Bilangan Oksidasi dan Contohnya
Halo coffee Friends kali ini kita di sajikan sebuah reaksi redoks kemudian ditanyakan berapakah bilangan oksidasi MN itu mengalami perubahan dari berapa menjadi berapa maka yang kita lihat adalah mno2 dengan mncl2 kita akan membuat aturan biloks yaitu aturan biloks adalah untuk mno2 mno2 kita akan menggunakan aturan biloks ketiga dan aturan biloks ke-7 di mana bilangan oksidasi MN ditambah 2.

Bilangan Oksidasi Atom Mn YouTube
Reaksi redoks dapat dibedakan berdasarkan perubahan bilangan oksidasi, sehigga untuk menentukan spesi yang mengalami reduksi dan oksidasi, perlu diketahui nilai biloksnya. Penentuan Bilangan Oksidasi Penentuan bilangan oksidasi dapat dilakukan dengan mengikuti aturan berikut [3, 4]. Total biloks semua atom sama dengan muatan atom, molekul, atau ion

Cara mudah menentukan bilangan oksidasi dalam senyawa kimia YouTube
Berdasarkan reaksi di atas, biloks unsur Mn mengalami perubahan dari +6 menjadi +7 dan +4. Reaksi ini merupakan reaksi redoks spesial/autoredoks, yaitu reaksi disproporsionasi dimana reduktor dan oksidatornya adalah senyawa yang sama.. Unsur klorin dalam senyawa dapat ditemukan dengan bilangan oksidasi dari -1 hingga +7. Diantara ion-ion ClO.

Contoh Reaksi Reduksi Dan Oksidasi Berdasarkan Perubahan Bilangan Oksidasi Sketsa
1. Bilangan oksidasi unsur bebas adalah 0 (nol) 2. Bilangan oksidasi ion monoatomik sama dengan muatannya. 3. Jumlah bilangan oksidasi semua atom unsur yang terdapat dalam dalam sebuah senyawa adalah 0 (nol) 4. Bilangan oksidasi atom-atom pembentuk ion poliatomik sama dengan muatannya. 5.

Perubahan bilangan oksidasi I dalam reaksi 6 I2 +6 H2O >...
Mn mengalami perubahan biloks dari +4 menjadi +2 dan Cl mengalami perubahan biloks dari -1 menjadi 0. Persamaan reaksi redoks soal di atas dapat dituliskan seperti di bawah ini. MnO2 +2NaCl+2H2SO4 → MnSO4 +Na2SO4 +2H2O +Cl2. Dari persamaan reaksi redoks tersebut, yang mengalami perubahan bilangan oksidasi adalah atom Mn dan Cl.

Bilangan Oksidasi S Yang Terkecil Terdapat Dalam Lengkap
Perubahan bilangan oksidasi disebabkan adanya transfer elektron.. Jika bilangan oksidasi mengalami kenaikan, maka telah terjadi reaksi oksidasi. Sebaliknya, jika bilangan ini mengalami penurunan, maka telah terjadi reaksi reduksi.. Jadi, bilangan oksidasi unsur K, Mn, dan O dalam KMnO4 adalah +1, +7, dan -2.
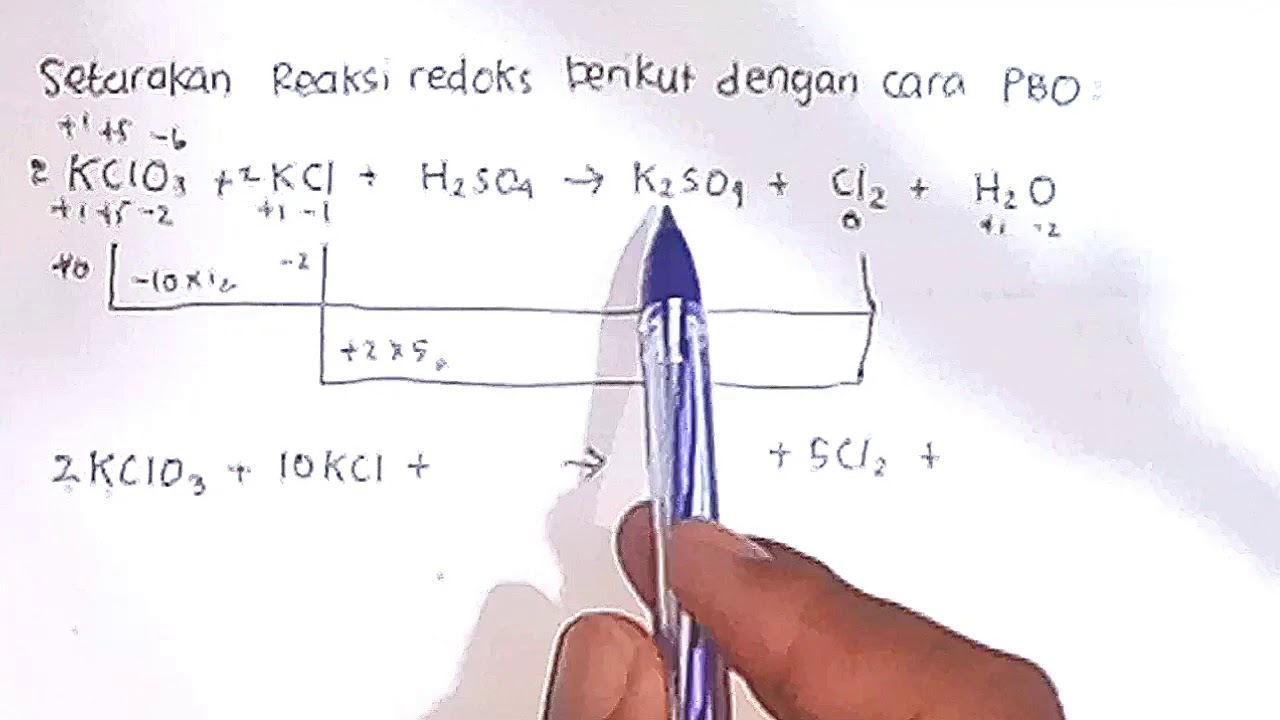
Cara Perubahan Bilangan Oksidasi Coretan
Oksidator adalah zat yang mengalami penurunan bilangan oksidasi. Reduktor adalah zat yang mengalami kenaikan bilangan oksidasi. Lebih mudahnya, perhatikan contoh soal reaksi redoks berdasarkan bilangan oksidasi berikut ini: Tentukan apakah reaksi berikut termasuk ke dalam reaksi redoks atau bukan redoks! Jika iya, tentukan oksidator, reduktor.

Bilangan Oksidasi Mn Berubah Dari
Bilangan Oksidasi : Bilangan Oksidasi besi ( F e Fe ) berubah dari +3 menjadi O. Bilangan oksidasi timbal ( S n Sn ) berubah dari -2 menjadi +4. Baca juga: Hukum-Hukum Dasar Kimia. Sobat Pijar, semoga pemahaman tentang perubahan oksidasi dan reduksi membawa kita lebih dekat pada kekayaan interaksi molekuler yang membangun segala.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Unsur yang mengalami perubahan bilangan oksidasi adalah Mn, yaitu dari +7 menjadi +2 dan Cl yaitu dari -1 menjadi 0. 2. Memberi koefisien yang sesuai pada unsur-unsur yang mengalami perubahan bilangan oksidasi. Atom Mn sudah setara. Atom Cl belum setara, di ruas kanan terdapat 2 atom Cl sedangkan di sebelah kiri hanya terdapat satu atom Cl.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Jumlah bilangan oksidasi dari unsur - unsur dalam suatu senyawa adalah 0. Contoh dalam senyawa H 2 O,. Setarakan jumlah atom pada spesi yang akan mengalami perubahan biloks; Jika suasana asam, tambahkan molekul H 2 O pada sisi yang kekurangan atom O;. MnO 4 - + 8H + + 5e Mn 2+ + 4H 2 O (x2) 2Cl - Cl 2 + 2e.