Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10 Belajar
A. Perbedaan Larutan Berdasarkan Daya Hantar Listrik. Berdasarkan daya hantar listriknya, larutan terbagi menjadi 2 golongan yaitu larutan elektrolit dan larutan non elektrolit. 1. LARUTAN ELEKTROLIT. Larutan yang dapat menghantarkan listrik karena mengalami proses ionisasi (terurai menjadi ion positif dan negatif).
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
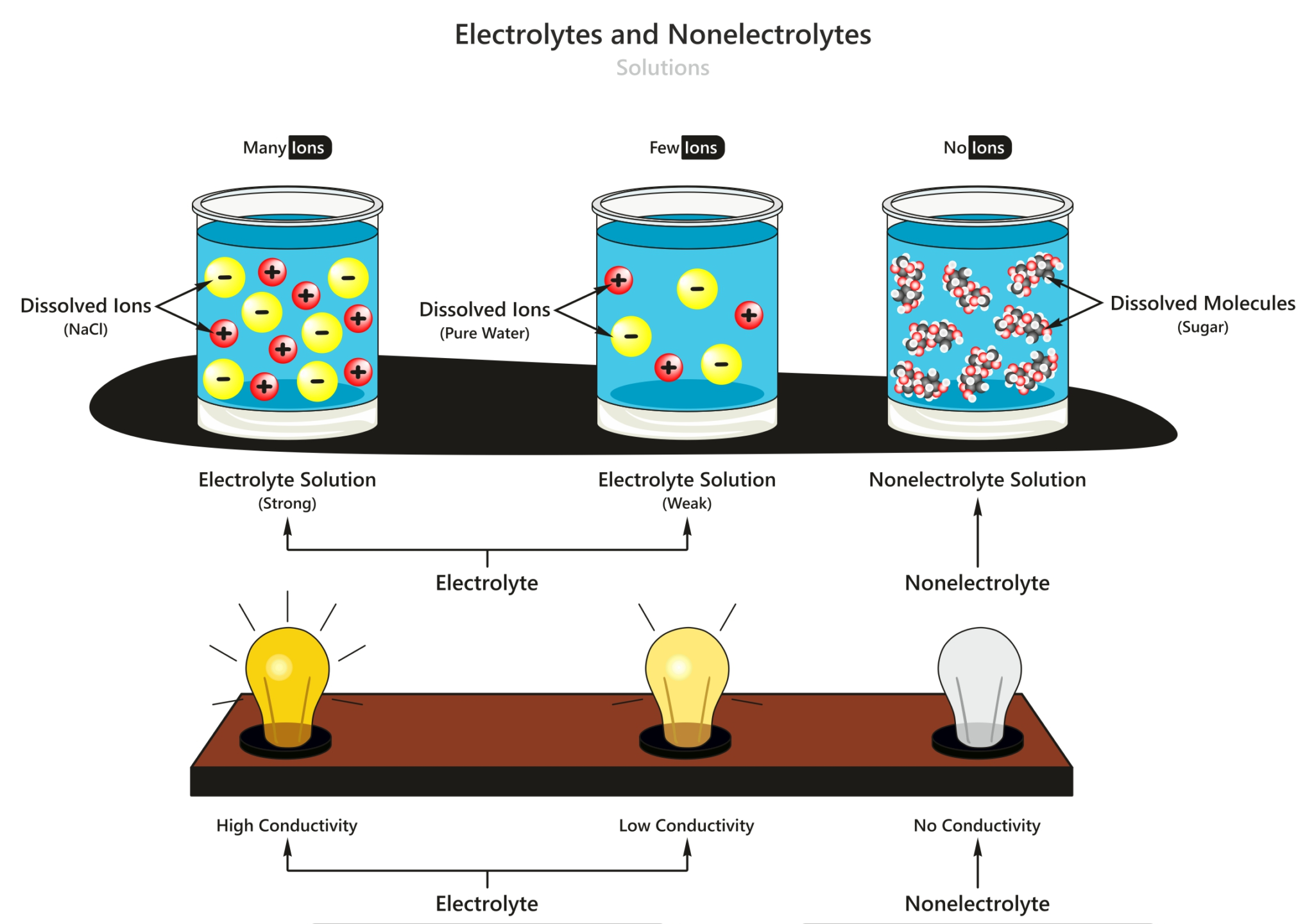
Larutan elektrolit dapat memecah menjadi ion-ion saat larut dalam air dan dapat menghantarkan arus listrik, sedangkan larutan non-elektrolit tidak dapat membentuk ion-ion dan tidak menghantarkan arus listrik. Perbedaan ini bergantung pada jenis zat yang terlarut dalam larutan serta tingkat kelarutan zat tersebut.

PPT LARUTAN ELEKTROLIT DAN NON ELEKTROLIT PowerPoint Presentation, free download ID4715206
Perbedaan utama antara larutan elektrolit dengan non elektrolit ialah terletak pada kemampuan menghantar listriknya. Namun, terdapat perbedaan larutan elektrolit dan non elektrolit yang lain, yaitu: Larutan elektrolit mempunyai derajat ionisasi antara 0 hingga 1, sedangkan derajat ionisasi larutan non elektrolit tidak ada atau 0.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
Video ini menjelaskan tentang konsep larutan elektrolit dan non elektrolit yang dilengkapi dengan contoh-contoh soal dan aplikasi dalam kehidupan sehari-hari.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
Berikut adalah manfaat larutan non elektrolit. 1. Sebagai sumber energi. Gula adalah salah satu komponen larutan non elektrolit. Gula ini merupakan sumber energi dalam bentuk karbohidrat sederhana. Ketika tubuh manusia kekurangan gula, maka akan terasa lelah, jantung berdebar, dan sulit berkonsentrasi.

PPT ** Tugas bahan ajar Kimia** PowerPoint Presentation, free download ID5411227
Contoh Larutan Elektrolit dan Nonelektrolit. Kami akan memberikan beberapa contoh konkret dari masing-masing tipe larutan untuk lebih menggambarkan perbedaannya. Larutan Asam Klorida (HCl): Ketika HCl larut dalam air, ia terdisosiasi menjadi ion hidrogen (H⁺) dan ion klorida (Cl⁻), sehingga menjadi larutan elektrolit kuat. Larutan Natrium.

Larutan Elektrolit dan Non Elektrolit
Seperti namanya, larutan non-elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Jika disekitar penghantar listrik (electrode) tidak muncul gelembung-gelembung gas, dan lampu tidak menyala ketika diuji. Ciri-ciri dari larutan non-elektrolit: Pada larutan non elektrolit, senyawa dalam air tidak mengalami proses ionisasi.

Larutan Elektrolit dan Non Elektrolit (Kompone
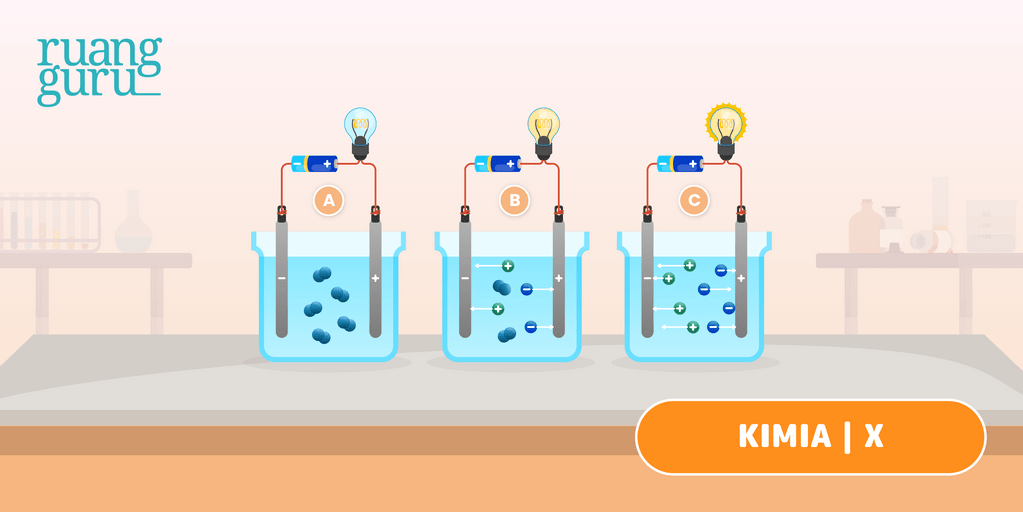
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut: Sifat larutan elektrolit: Dapat menghantarkan listrik. Memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1. Jika dinyalakan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala.

Larutan Elektrolit dan Reaksi Redoks Kelas 10 • Part 1 Larutan Elektrolit dan Nonelektrolit
Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah memiliki derajat ionisasi jauh dibawah 1, berarti zat terlarut yang berubah menjadi ion hanya sedikit. Hal ini menyebabkan larutan elektrolit lemah menghantarkan listrik dengan kurang baik.

Larutan elektrolit dan non elektrolit
Sobat Pijar, itulah wawasan tentang larutan elektrolit dan larutan non elektrolit. Semoga penjelasan tadi dapat membantumu memahami perbedaan keduanya dan memberikan gambaran lebih jelas tentang sifat-sifat unik yang dimiliki oleh masing-masing jenis larutan, ya! Gimana, semakin tertarik belajar Larutan Elektrolit dan Non Elektrolit lebih lanjut?

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Perbedaan Larutan Elektrolit dan Non Elektrolit Masmiani dalam uraian "Larutan Elektrolit, Larutan Non Elektrolit, dan Asam Basa" menyatakan bahwa larutan elektrolit mengandung partikel bermuatan kation dan anion. Jika larutan elektrolit dialirkan listrik (elektron), akan terjadi suatu proses yang dinamakan elektrolisis.

SifatSifat Larutan Elektrolit dan Nonelektrolit Memotivasi Diri
Pada larutan non elektrolit, zat non elektrolit yang terlarut tidak dapat terurai menjadi ion-ion, sehingga tidak terdapat ion-ion bebas yang dapat menghantarkan arus listrik. Sebagai contoh, larutan gula sukrosa (C 12 H 22 O 11 ) merupakan larutan non elektrolit.

Larutan Elektrolit dan Non Elektrolit, Ini Contoh dan Perbedaannya!
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
Larutan elektrolit yang memberikan gejala berupa lampu menyala dan membentuk gelembung gas disebut elektrolit kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur. Adapun elektrolit yang tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas termasuk elektrolit lemah. Contohnya yaitu larutan amonia, larutan cuka,dan.

Larutan Elektrolit dan Nonelektrolit
Zat yang tergolong non elektrolit biasanya dimiliki oleh larutan alkohol (C 2 H 5 OH, C 3 H 7 OH) larutan gula (C 6 H 12 O 6), larutan urea (CO(NH 2) 2, dan lain-lain. Jadi, secara singkat perbedaan larutan elektrolit dan non elektrolit bisa kamu lihat pada tabel di bawah ini ya!

Materi Kimia Elektrolit dan Non Elektrolit YouTube
Jumlah partikel larutan elektrolit lebih banyak daripada larutan non-elektrolit sehingga sifat koligatifnya pun akan lebih besar. Nilai dari sifat koligatif larutan non-elektrolit dapat diketahui dengan rumus-rumus berikut ini: Penurunan tekanan uap. ΔP = P⁰.